1. Função e relevância do ácido fítico
O ácido fítico (InsP6) e seus sais (fitato) são compostos naturais presentes em ingredientes vegetais, sendo a principal forma de fósforo armazenado em sementes e grãos. Como resultado, o fitato está presente em dietas para monogástricos, que não possuem enzimas endógenas capazes de degradá-lo eficientemente.
O ácido fítico apresenta desafios nutricionais, uma vez que tem uma forte tendência a se ligar a minerais e proteínas, reduzindo sua biodisponibilidade.
Compreender sua estrutura e impacto é essencial para práticas alimentares sustentáveis.
2. Estrutura do ácido fítico
O ácido fítico, quimicamente conhecido como hexaquisfosfato de mio-inositol (IP6), é formado por um anel de mio-inositol com 6 grupos fosfato ligados um em cada átomo de carbono (Figura 1) (FEDNA, 2021).
Nos ingredientes vegetais, o ácido fítico raramente existe como um ácido livre. Em vez disso, forma sais com minerais como cálcio, magnésio e potássio, ou mesmo com proteínas e amidos, formando estruturas mais complexas. Esses sais são conhecidos como fitatos ou fitina (Humer e Schwarz, 2014; Outchkourov e Petkov, 2019).
A molécula de ácido fítico possui 12 prótons substituíveis, conferindo alto potencial eletronegativo em pH próximo ao neutro. Isso torna a molécula altamente reativa e instável em sua forma livre (Humer e Schwarz, 2014) (Figura 1 e 2).
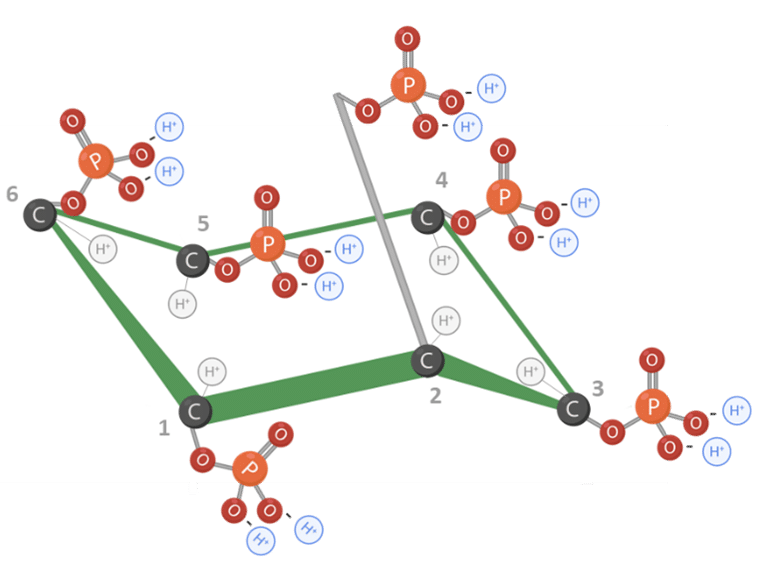
Figura 1: Estrutura molecular do ácido fítico. Adaptado de Vieira et al., 2018. Criado em BioRender.com
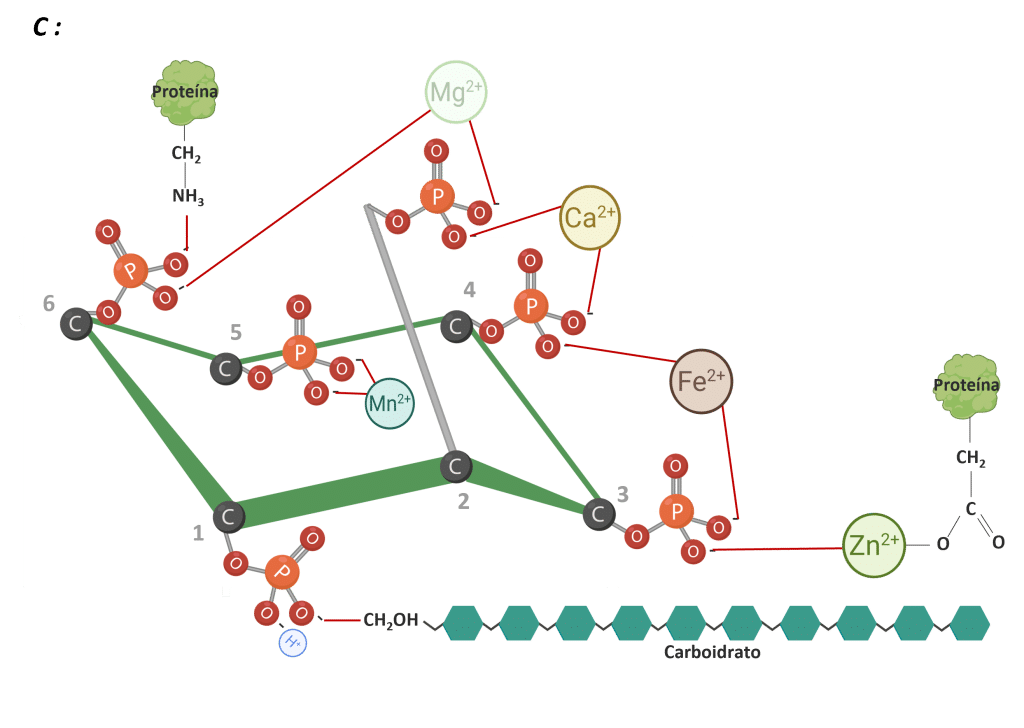
Figura 2: IP6 ligado a diferentes nutrientes. Adaptado de Vieira et al., 2018. Criado em BioRender.com
3. Presença de fitato nas matérias-primas
Nas sementes vegetais, o ácido fítico é a principal forma de armazenamento de fósforo. Ele se acumula durante o desenvolvimento das sementes e é armazenado em vacúolos especializados, chamados globóides (Figura 3) (Bohn et al., 2007; Kumar et al., 2019).
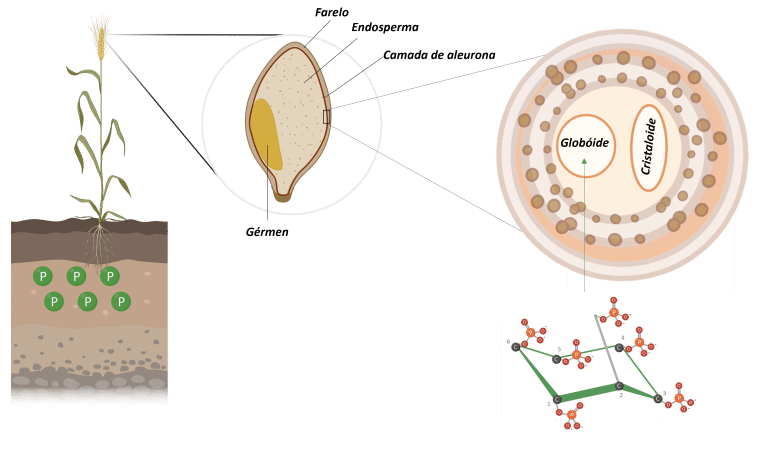
Figura 3: Armazenamento de fitato em grânulos de trigo. Adaptado de Freed et al., 2020
As concentrações de fitato variam amplamente entre os ingredientes da ração. Cerca de 50-80% do fósforo total em cereais e oleaginosas existe na forma de ácido fítico ou fitato (Kavitha, 2016; Kumar et al., 2019).
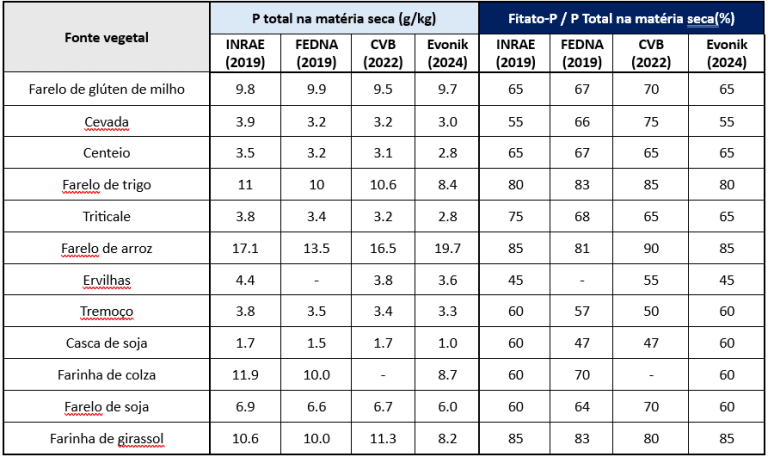
As dietas monogástricas contêm cerca de 0,2 a 0,3% de fósforo ligado ao fitato (InsP6-P), variando conforme a matéria-prima utilizada e suas condições de cultivo e processamento (Tabela 1) (Rodehutscord et al., 2016; Outchkourov e Petkov, 2019).
Tabela 1: Teor de fósforo (P) total e proporção de fitato-P (InsP6-P) com base em diferentes matérias-primas utilizadas na alimentação
Dada a variabilidade na composição do fitato e sua suscetibilidade à hidrólise em diferentes alimentos, torna-se essencial entender como o fitato é decomposto.
4. Degradação do fitato: fitases e atividade microbiana
A hidrólise do fitato envolve a remoção gradual de grupos fosfato da molécula de InsP6, resultando em fosfatos de inositol mais baixos, como InsP5, InsP4 e InsP3. Esse processo pode ocorrer por meio de 3 fontes principais de atividade da fitase: fitases intrínsecas de plantas, fitases microbianas associadas à mucosa intestinal e suplementação de fitase exógena (Humer e Schwarz, 2014; Rodehutscord e Rosenfelder 2016).
4.1. Fitases vegetais
A atividade endógena da fitase nas plantas desempenha um papel fundamental na quebra inicial do fitato. Cereais como centeio, trigo, cevada e seus subprodutos exibem altos níveis de fitase endógena, enquanto leguminosas e oleaginosas geralmente apresentam menor atividade (FEDNA, 2021). No entanto, as fitases vegetais são termolábeis, por exemplo, a peletização em temperaturas acima de 85 °C pode inativar até 74% da atividade da fitase (Outchkourov e Petkov, 2019).
4.2. Efeito do trato gastrointestinal de aves (TGI)
O trato digestivo desempenha um papel na quebra do fitato. O papo, embora não seja um local importante de absorção, pode iniciar a hidrólise do fitato por meio da atividade microbiana. Embora o curto tempo de retenção da digesta pode limitar a ação enzimática (Kerr et al., 2000; Witzig et al., 2015).
No ceco, existe uma comunidade microbiana altamente diversificada com atividade substancial de fitase. No entanto, apesar do potencial enzimático, a relevância nutricional da hidrólise do fitato no ceco é limitada (Zeller et al., 2015), e o fósforo liberado no ceco é majoritariamente excretado devido à falta de absorção pós-ileal (Son et al., 2002).
4.3. Fitases microbianas exógenas
O uso de fitases microbianas exógenas tornou-se uma das estratégias mais eficazes para aumentar a biodisponibilidade do fósforo na nutrição monogástrica (Kumar e Sinha, 2018). O estômago é o principal local de atividade da fitase devido ao seu baixo pH. Uma vez que o alimento passa para o intestino, a atividade da fitase diminui devido à redução da solubilidade do fitato e condições de pH menos favoráveis (Humer e Schwarz, 2014. Kumar et al., 2019).
A eficácia da fitase depende da estabilidade do pH e da temperatura, da afinidade do substrato, da resistência à proteólise, do tempo de retenção gastrointestinal, e de fatores dietéticos como a relação Ca:P e a concentração de fitato (Kumar et al., 2019). Apesar dos avanços na tecnologia de fitase, a desfosforilação completa de IP6 é raramente alcançada (Menezes-Blackburn et al., 2015).
Entender as estratégias enzimáticas é essencial para melhorar o uso do fósforo e reduzir seu efeito antinutricional.
5. Interações do fitato com nutrientes
Além de seu papel como fonte de fósforo orgânico, o fitato pode apresentar efeitos antinutricionais que comprometem a absorção e aproveitamento de nutrientes.
5.1. Interações fitato-mineral
O fitato pode interagir com minerais essenciais (Figura 4). Essas interações resultam na formação de complexos fitato-minerais insolúveis que são mal absorvidos no intestino, reduzindo a biodisponibilidade mineral (Kumar e Sinha, 2018; Outchkourov e Petkov, 2019).
De acordo com Cheryan (1980), a ligação mineral do fitato segue uma ordem geral de estabilidade: Zn²⁺ >Cu²⁺ > Ni²⁺ > Co²⁺ > Mn²⁺ > Ca²⁺ > Fe²⁺. Essa hierarquia reflete os vários graus em que diferentes minerais são afetados pela quelação do fitato.
A fim de obter uma solubilidade suficiente dos minerais e dos ésteres de ácido fítico a um pH mais elevado, pode exigir uma hidrólise precoce do fitato, idealmente no estômago, para reduzir a formação de complexos e aumentar a absorção de minerais.
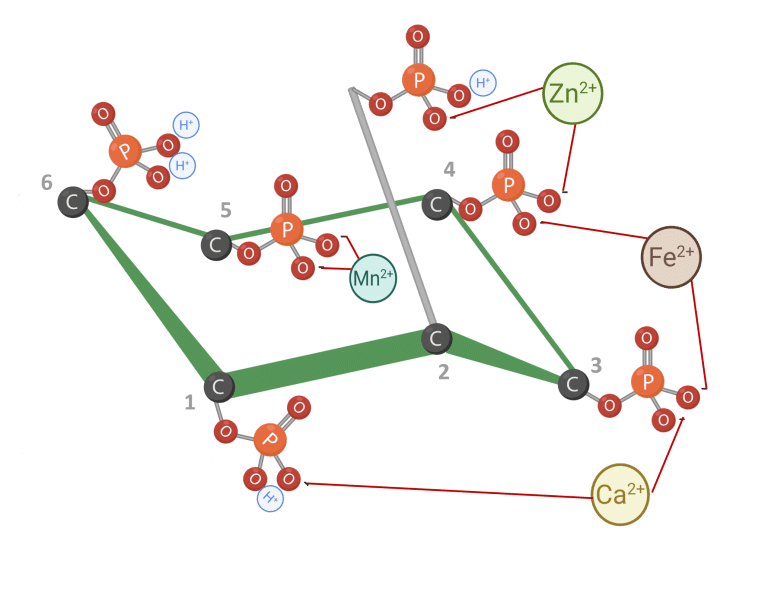
Figura 4: IP6 ligado a cátions. Adaptado de Vieira et al. (2018). Criado em BioRender.com
5.2. Interações fitato-proteína
O fitato pode prejudicar a utilização de proteínas através da formação de complexos fitato-proteína (Humer et al., 2014). Em baixos valores de pH, o fitato interage diretamente com os aminoácidos básicos. À medida que o pH aumenta no intestino delgado, o fitato pode formar ligação ternária com proteínas e cátions multivalentes, como o cálcio (Figura 5) (Reddy e Salunkhe, 1981; Humer et al., 2014; Nissar et al., 2017; Kumar et al., 2019).
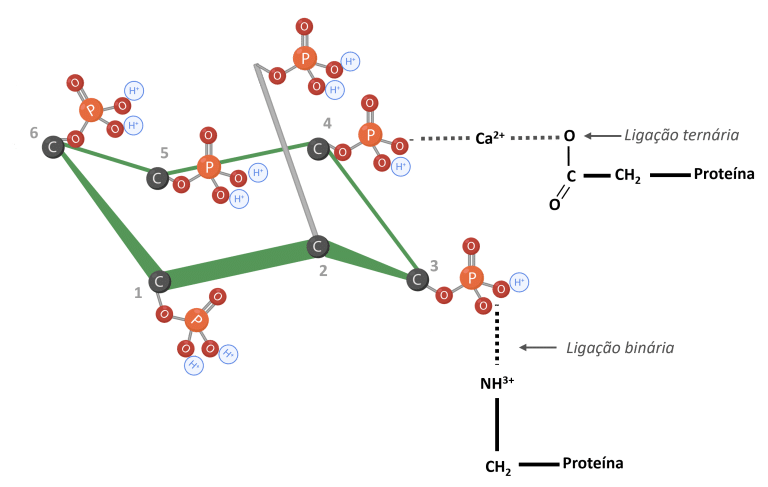
Figura 5: IP6 ligado a proteínas. Adaptado de Morales et al. (2016). Criado em BioRender.com
5.3. Interações nutricionais mais amplas do fitato
O fitato pode interagir com carboidratos formando complexos com amido (Figura 6) (Kumar et al., 2019). Da mesma forma, o fitato também pode interagir com lipídios, reduzindo a utilização de energia (Humer e Schwarz, 2014; Camden et al., 2001).
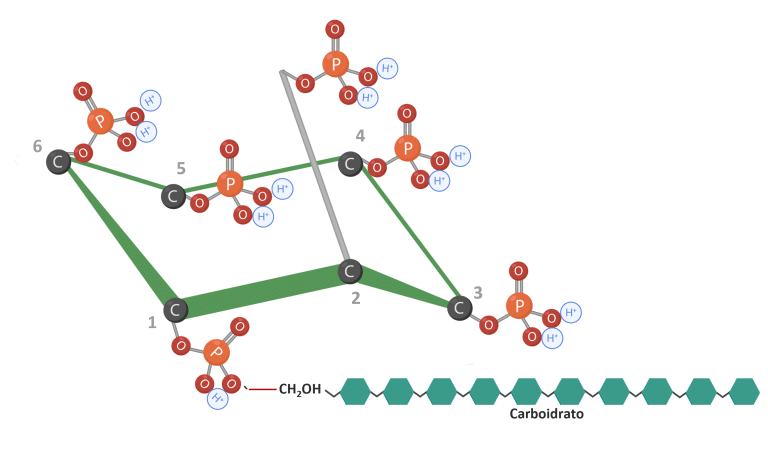
Figura 6: IP6 ligado a carboidratos. Adaptado de Vieira et al. (2018); Oatway et al. (2001). Criado em BioRender.com
O fitato limita a biodisponibilidade de nutrientes essenciais, afetando a eficiência alimentar. A suplementação com fosfato inorgânico atende às exigências de fósforo, mas não neutraliza os efeitos antinutricionais do fitato (Outchkourov e Petkov, 2019). No entanto, surgiram novas gerações de fosfatos funcionais para reduzir a formação de complexos insolúveis.
6. Matéria-prima funcional inovadora: Humofosfato de cálcio – limitando as interações com o fitato
Um dos desafios remanescentes na degradação do fitato é minimizar a formação de complexos insolúveis. Nesse contexto, o humofosfato de cálcio (HumIPHORA) representa uma abordagem inovadora e funcional. Ele combina fósforo, cálcio e substâncias húmicas – compostos orgânicos com propriedades quelantes que podem interagir com íons no trato gastrointestinal.
HumIPHORA tem a capacidade de se ligar a cátions divalentes, como o excesso de cálcio, reduzindo a interação com o ácido fítico. Isso limita a formação de complexos insolúveis de cálcio-fitato e mantém o fitato em uma forma mais hidrolisável. Consequentemente, a ação da fitase é facilitada, melhorando a liberação e absorção do fósforo proveniente de ingredientes vegetais.
Ao contrário das fontes convencionais de fosfato, HumIPHORA interage com os nutrientes do trato gastrointestinal e reduz os efeitos antinutricionais do cálcio e do fitato. Sua inclusão nas dietas avícolas favorece a degradação do fitato e melhora a absorção de nutrientes – particularmente fósforo e cálcio, essenciais para o crescimento e desenvolvimento esquelético.
Um ensaio experimental conduzido em colaboração com a Universidade de São Paulo confirma esse efeito, mostrando um teor significativamente maior de cinzas da tíbia em frangos de corte alimentados com dietas contendo HumIPHORA em comparação com aqueles com fosfato monocálcico (MCP) (Figura 7). O teor de cinzas na tíbia indica a mineralização óssea, refletindo a retenção de cálcio e fósforo e contribuindo para o desenvolvimento esquelético.
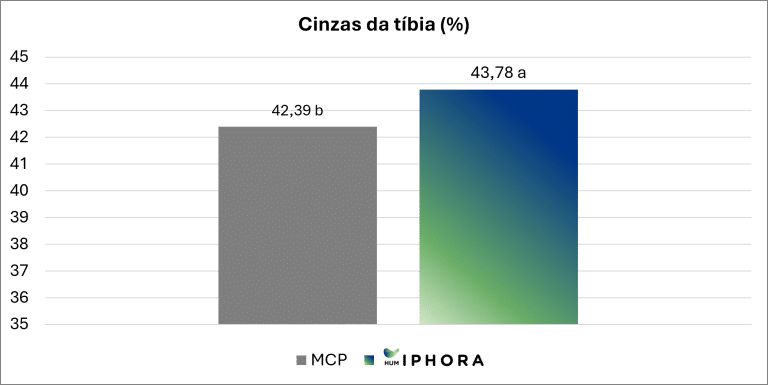
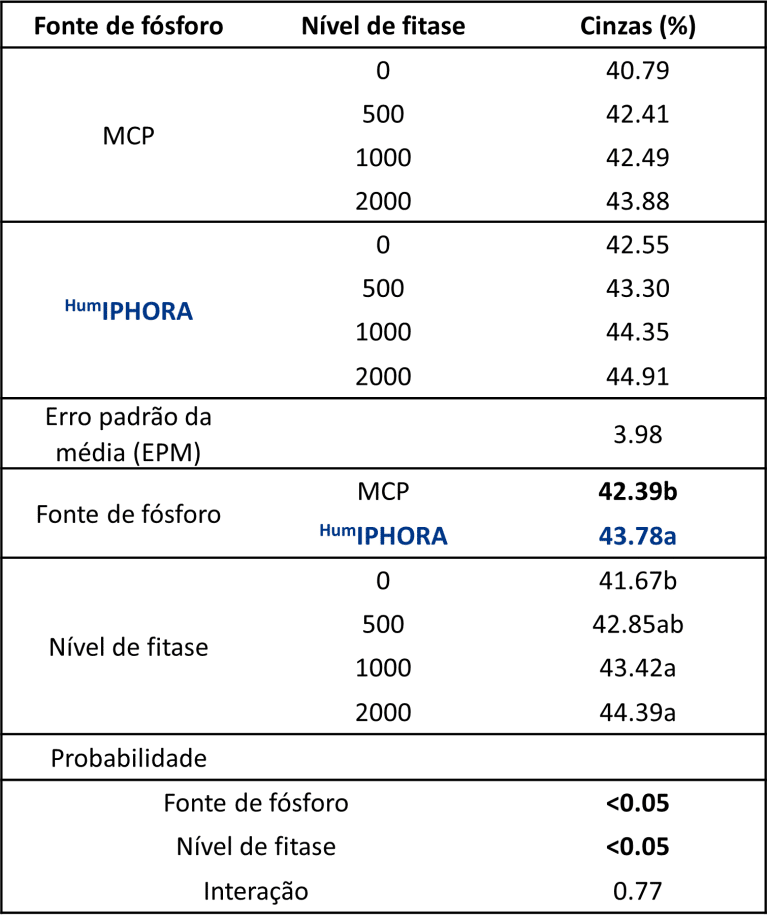
Figura 7: Efeito da inclusão de HumIPHORA em dietas de frangos de corte sobre o teor de cinzas na tíbia.
