1. Desafío de las enfermedades bacterianas y de la resistencia a los antimicrobianos
Las infecciones bacterianas representan uno de los desafíos más persistentes en la producción de monogástricos, afectando tanto a la salud animal como a la seguridad alimentaria (Mak et al., 2022). Una amplia gama de patógenos (por ejemplo, Escherichia coli, Salmonella enterica, Campylobacter jejuni/coli, Clostridium perfringens, etc.) puede colonizar el tracto gastrointestinal u otros tejidos (Mancabelli et al., 2016; Oakley et al., 2014; Kumar et al., 2018).
Estos organismos varían en patogenicidad e impacto: algunos comprometen principalmente la integridad intestinal y la absorción de nutrientes, mientras que otros causan infecciones sistémicas o suponen riesgos zoonóticos (Figura 1) a través de la contaminación de carcasas y huevos.
Históricamente, los antibióticos se usaron ampliamente para controlar estas enfermedades y mejorar la productividad (Mak et al., 2022). Sin embargo, estas prácticas han contribuido a la aparición y propagación de la resistencia antimicrobiana (RAM), ahora reconocida como una amenaza global para la salud animal y humana (Figura 2).
A medida que los sistemas de producción animal reducen el uso de antimicrobianos para abordar las preocupaciones sobre la RAM, los productores se enfrentan a nuevos desafíos: las infecciones bacterianas subclínicas a menudo permanecen indetectables, aunque desvían nutrientes hacia respuestas inmunitarias y reparación de tejidos, reduciendo la eficiencia alimentaria y la rentabilidad (Shen et al., 2010; Marcq et al., 2011; Quinteiro-Filho et al., 2012; Remus et al., 2014). Esta realidad subraya la necesidad de estrategias integradas que mantengan la salud intestinal y controlen las poblaciones bacterianas sin depender de los antibióticos.
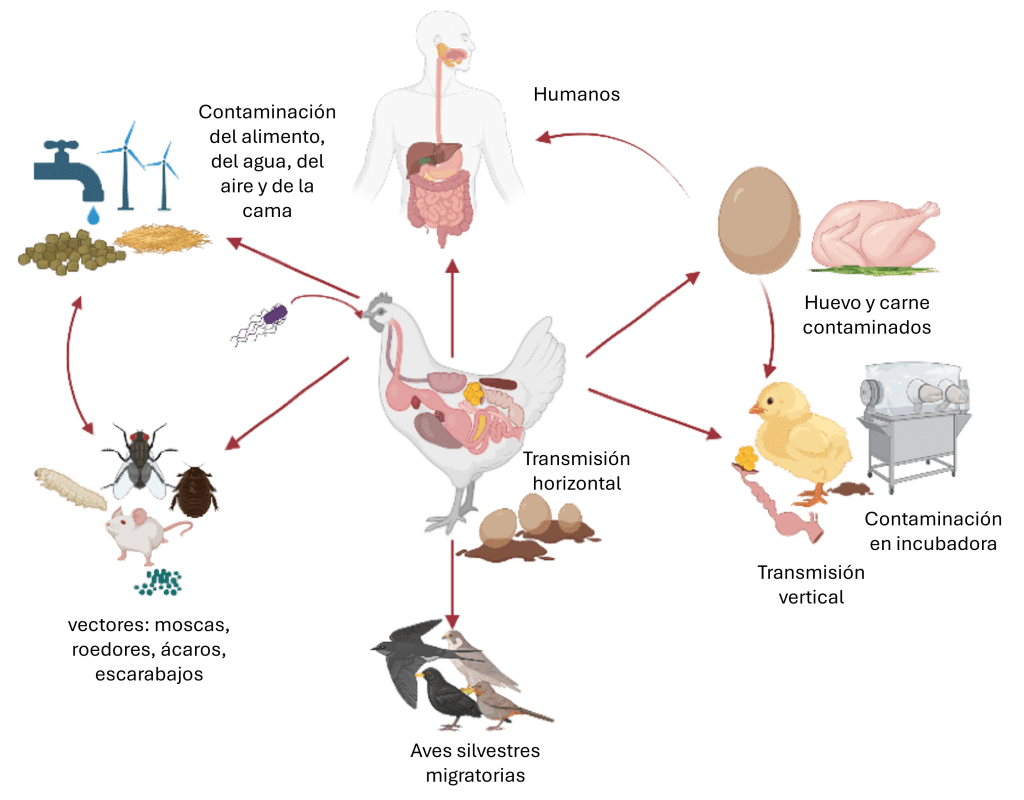
Figura 1: Un ejemplo con Salmonella spp. Una visión general de las distintas rutas de transmisión. Creado con BioRender.com
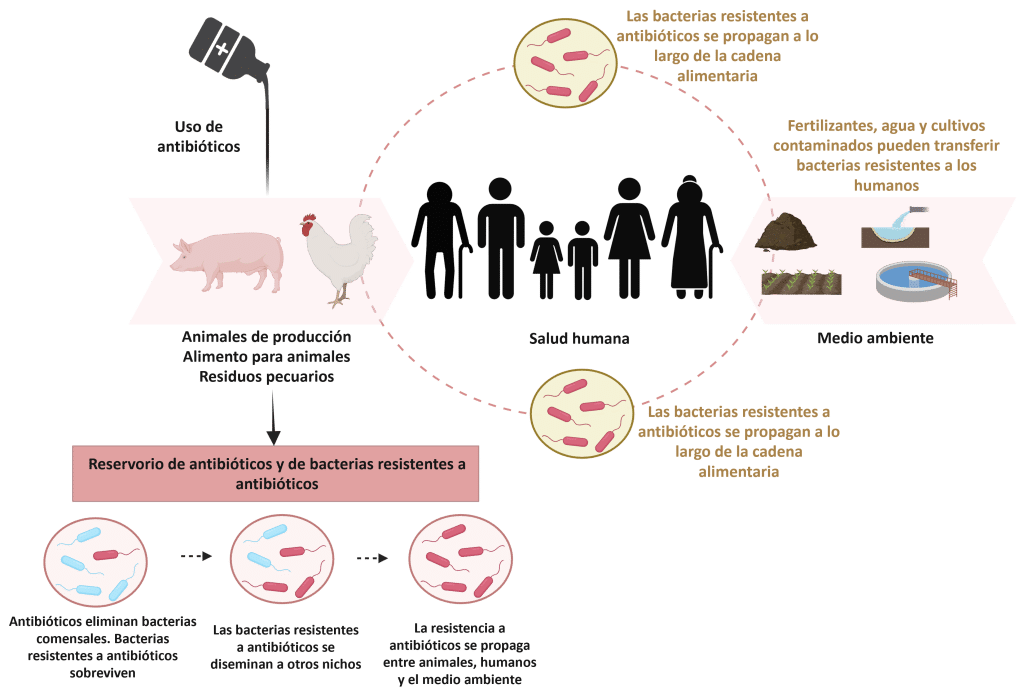
Figura 2: Resistencia a los antimicrobianos (RAM) en ganado, en humanos y en el medio ambiente. Adaptado de Silva et al. (2023). Creado con BioRender.com
2. Integridad intestinal, equilibrio de la microbiota y por qué la inflamación es costosa.
El tracto gastrointestinal (TGI) desempeña un papel central, actuando tanto como sistema de absorción de nutrientes como barrera contra patógenos (Pan, D., y Yu, Z., 2013). Su integridad depende de una microbiota equilibrada, respuestas inmunitarias eficientes y una capa epitelial funcional (Rodríguez, 2023). La microbiota intestinal puede dividirse en poblaciones luminales, que residen en la digesta, y poblaciones mucosas, adheridas a las células epiteliales. Ambas comunidades interactúan dinámicamente y pueden verse alteradas por factores dietéticos y estresores ambientales.
Cuando la integridad intestinal se ve comprometida, se pierde la homeostasis, lo que conduce a disbiosis, aumento de la permeabilidad de la barrera mucosa e inflamación (Dridi y Scanes, 2022; Eveaert, 2025). Inicialmente, la inflamación es protectora, pero la activación crónica desvía energía del crecimiento hacia la función inmunitaria y la reparación tisular (Teeter RG., 2007). Se estima que, para cumplir con los requisitos de aminoácidos para la síntesis de cada miligramo de proteína de respuesta inmune, se catabolizan 2.33 mg de proteína muscular (Reeds et al., 1994) (Figura 3).
Este cambio incrementa los requisitos de mantenimiento y reduce el consumo de alimento y la ganancia diaria de peso, perjudicando la eficiencia de conversión alimenticia (Latshaw, 1991; Shen et al., 2010; Marcq et al., 2011; Quinteiro-Filho et al., 2012). Los trastornos entéricos subclínicos son especialmente preocupantes porque persisten sin ser detectados, causando pérdidas acumuladas en productividad y rentabilidad.
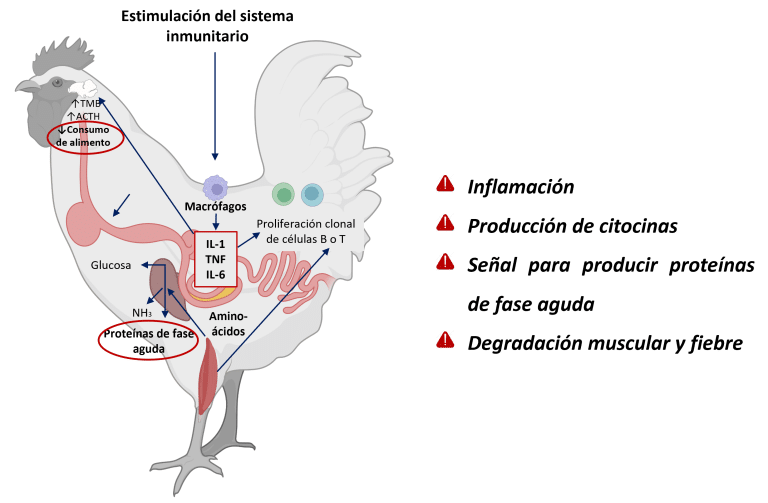
Figura 3: Cascada inflamatoria en pollos: la invasión del patógeno activa células inmunitarias (macrófagos), desencadenando la liberación de citocinas (IL-1, TNF, IL-6). Estas señales estimulan el hígado para producir proteínas de fase aguda, mientras que los efectos sistémicos incluyen la descomposición de proteínas musculares para el suministro de aminoácidos y la inducción de fiebre mediante regulación hipotálmica. Adaptado de Klein (2020); Dridi y Scanes (2022); Schothorst Feed Research (2024). Creado con BioRender.com
En sistemas intensivos, donde los animales están expuestos al hacinamiento y al estrés, estas condiciones se amplifican, creando un entorno favorable para patógenos oportunistas.
3. Especies patógenas relevantes
La microbiota animal también puede albergar especies comensales y patógenas (por ejemplo, Escherichia coli, Salmonella enterica, Campylobacter jejuni o Clostridium perfringens) (Dridi y Scanes, 2022). Estos patógenos se asocian frecuentemente con infecciones entéricas o sistémicas y representan importantes preocupaciones para la salud animal y la seguridad alimentaria. Además, su compleja superficie celular confiere resistencia intrínseca a múltiples antibióticos, lo que complica las estrategias de control (Miller, 2016).
Las condiciones comunes en sistemas avícolas intensivos, como la alta densidad de alojamiento, el estrés ambiental y los desequilibrios dietéticos, favorecen la colonización de estos patógenos en el tracto gastrointestinal. Aunque algunas infecciones son agudas y fácilmente detectables, muchas ocurren de forma subclínica, reduciendo el rendimiento productivo y la eficiencia alimentaria sin signos clínicos evidentes. Esta complejidad subraya la importancia de estrategias preventivas que aborden tanto la salud intestinal como el control de patógenos.
3.1. Factores de predisposición e impacto subclínico
Varios factores predisponen a los animales al sobrecrecimiento bacteriano y a enfermedades. Entre estos, los coccidios (Figura 4) sont un desencadenante principal, dañando la mucosa intestinal y creando condiciones favorables para la proliferación de Clostridium perfringens y la producción de toxinas (Rodríguez, 2023).
La coccidiosis subclínica es muy prevalente, con informes que indican una media del 34.8 % en los enigmas (Gazoni et al., 2021) y una pérdida de producción estimada del 9 % en sistemas europeos (Teeter RG et al., 2008). Incluso las lesiones leves pueden afectar la absorción de nutrientes, reducir la ingesta de energía y empeorar el índice de conversión (IC). Además, los desafíos tardíos con coccidia (pollos de engorde de 35 a 42 días) tienen el impacto más severo, reduciendo la ganancia media diaria hasta en un 25 % y aumentando significativamente el IC (Teeter RG et al., 2008).
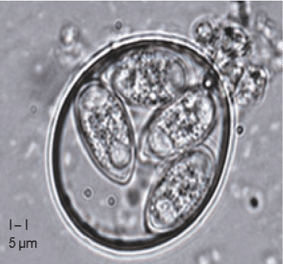
Figura 4: Ooquiste esporulado de Eimeria tenella (You M, 2024)
3.2. Rendimiento e impacto económico de 2 patógenos entéricos
La E. coli patógena aviar (APEC) y Clostridium perfringens son dos de los patógenos entéricos más significativos económicamente en la producción avícola, responsables respectivamente de la colibacilosis y la enteritis necrótica (EN). Ambos patógenos están asociados con un rendimiento de crecimiento deteriorado y un aumento de la mortalidad en lotes comerciales (Mak et al., 2022) (Figura 5).

Figura 5: E. coli patógena aviar (APEC)
La colibacilosis conduce a condiciones sistémicas como colisepticemia, aerosaculitis, peritonitis, celulitis y salpingitis (Mak et al., 2022).
- Las tasas de mortalidad en aves jóvenes oscilan entre el 20 % y el 53,5 %, mientras que los supervivientes suelen mostrar un peso corporal reducido (−2 %), un deterioro del IC (−2.7 %) y hasta un 20 % menos producción y capacidad de eclosión de huevos (Olsen et al., 2012; Nolan et al., 2020).
- En Brasil, los mataderos rechazan hasta el 45.2 % de las carcasas debido a la celulitis, lo que representa pérdidas anuales de aproximadamente 10 millones de dólares (Fallavena et al., 2000).
- Además, las cepas APEC se asocian comúnmente con altos niveles de resistencia antimicrobiana, lo que complica el tratamiento y las estrategias de control (Van Limbergen et al., 2020).
Clostridium perfringens causa enteritis necrótica (EN), que puede ser clínica o subclínica (Hargis, 2023) (Figura 6).
- Esta bacteria Gram-positiva es un organismo comensal, presente en el 75–90 % de las aves, pero bajo condiciones favorables puede proliferar y causar enteritis necrótica.
- En aves, la EN clínica puede resultar en tasas de mortalidad diaria de hasta el 1 %.
- La EN subclínica, estimada en un 20 % de prevalencia, puede reducir el peso corporal en un 12 % y aumentar el IC en un 10.9 % (Skinned et al., 2010; Wade y Keyburn, 2015).
- El impacto económico global de EN se estima entre 5 – 6 mil millones de dólares anuales (Wade y Keyburn, 2015).
Estas cifras subrayan el coste oculto de las infecciones subclínicas, que a menudo permanecen sin diagnosticar pero comprometen significativamente la rentabilidad.
La reducción de los antibióticos en la producción animal ha impulsado la búsqueda de alternativas, incluyendo materias primas funcionales que puedan contribuir a la modulación microbiana y favorecer la integridad intestinal.
Figura 6: Clostridium perfringens
4. Efectos del fosfato funcional: Humofosfato de calcio y su impacto en la proliferación bacteriana
El humofosfato de calcio (HumIPHORA) es un fosfato funcional, obtenido mediante la reacción del ácido fosfórico, el calcio y las sustancias húmicas (SH). Su mecanismo principal de acción consiste en limitar la formación de complejos insolubles. Más allá de esto, su composición también aporta beneficios secundarios para la salud intestinal.
En nutrición animal, las SH ha demostrado propiedades antimicrobianas, antiinflamatorias e inmunomoduladoras. Su capacidad para formar capas protectoras sobre el epitelio intestinal ayuda a prevenir la adhesión y la translocación de bacterias y toxinas patógenas, contribuyendo a una mejora de la integridad de la mucosa (Arif et al., 2019; Domínguez-Negrete et al., 2019; Zanin et al., 2019). La integración de sustancias húmicas en matrices minerales como el humofosfato de calcio puede potenciar su actividad biológica, apoyando la salud intestinal y el equilibrio microbiano en animales monogástricos.
Se llevó a cabo un ensayo in vitro en el ‘Centre Mondial de l’Innovation (CMI)’ utilizando el método spot para evaluar el potencial antimicrobiano de HumIPHORA frente a una fuente inorgánica convencional de fosfato para alimento (fosfato monocálcico, MCP) (Figura 7).
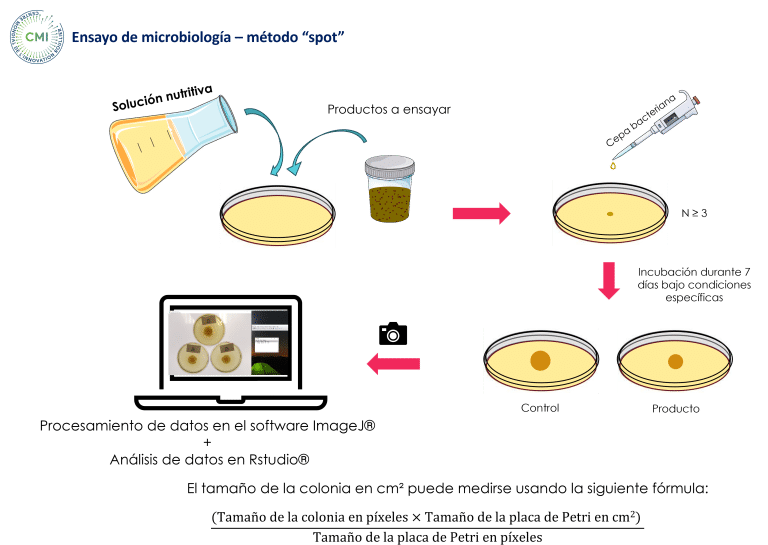
Figura 7: Ensayo microbiológico – método “spot” realizado en nuestro ensayo in vitro (CMI, 2025)
HumIPHORA mostró mayores efectos inhibidores contra Escherichia coli y Clostridium perfringens en comparación con MCP (Figura 8). Estos resultados refuerzan la relevancia microbiológica del humofosfato de calcio y son consistentes con observaciones previas in vivo en porcinos, donde se reportó una menor incidencia de diarrea. Además, los ensayos de campo sugieren que el uso de HumIPHORA puede tener un efecto positivo sobre la mortalidad de las aves. Por ejemplo, en un ensayo con pollos de engorde bajo estrés térmico, la mortalidad acumulada del día 0 al 42 fue del 9.3% con el grupo HumIPHORA frente al 14.5% con fosfato dicálcico (DCP). Este efecto también puede observarse en polluelos durante los primeros días de vida, cuando son fisiológicamente inmaduros y más vulnerables al estrés oxidativo (Baeza y Coudert, 2023).
HumIPHORA muestra una prometedora actividad antimicrobiana y posibles beneficios en animales monogástricos. Estos hallazgos abren perspectivas para una validación adicional mediante ensayos controlados in vivo y estudios experimentales adicionales de rendimiento productivo.
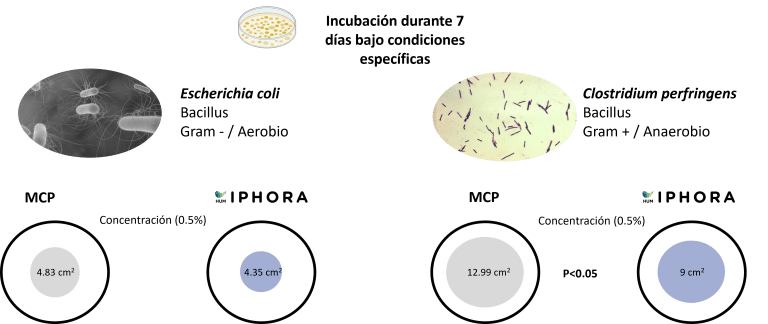
Figura 8: Efecto de HumIPHORA en el crecimiento bacteriano (E. coli y C. perfringens)
