1. Desafio das doenças bacterianas e da resistência aos antimicrobianos
As infecções bacterianas representam um dos desafios mais persistentes na produção de monogástricos, afetando tanto a saúde animal quanto a segurança alimentar (Mak et al., 2022). Uma ampla variedade de patógenos (por exemplo, Escherichia coli, Salmonella enterica, Campylobacter jejuni/coli, Clostridium perfringens, etc.) pode colonizar o trato gastrointestinal ou outros tecidos (Mancabelli et al., 2016; Oakley et al., 2014; Kumar et al., 2018).
Esses organismos variam em patogenicidade e impacto: alguns comprometem principalmente a integridade intestinal e a absorção de nutrientes, enquanto outros causam infecções sistêmicas ou apresentam riscos zoonóticos (Figura 1) por meio da contaminação de carcaças e ovos.
Historicamente, antibióticos foram amplamente usados para controlar essas doenças e melhorar a produtividade (Mak et al., 2022). No entanto, essas práticas contribuíram para o surgimento e disseminação da resistência aos antimicrobianos (RAM), agora reconhecida como uma ameaça global à saúde animal e humana (Figura 2).
À medida que os sistemas de produção animal reduzem o uso de antimicrobianos para tratar preocupações sobre a RAM, os produtores enfrentam novos desafios: infecções bacterianas subclínicas frequentemente permanecem indetectáveis, mas desviem nutrientes para respostas imunes e reparo tecidual, reduzindo a eficiência alimentar e a lucratividade (Shen et al., 2010; Marcq et al., 2011; Quinteiro-Filho et al., 2012; Remus et al., 2014). Essa realidade ressalta a necessidade de estratégias integradas que mantenham a saúde intestinal e controlem as populações bacterianas sem depender de antibióticos.
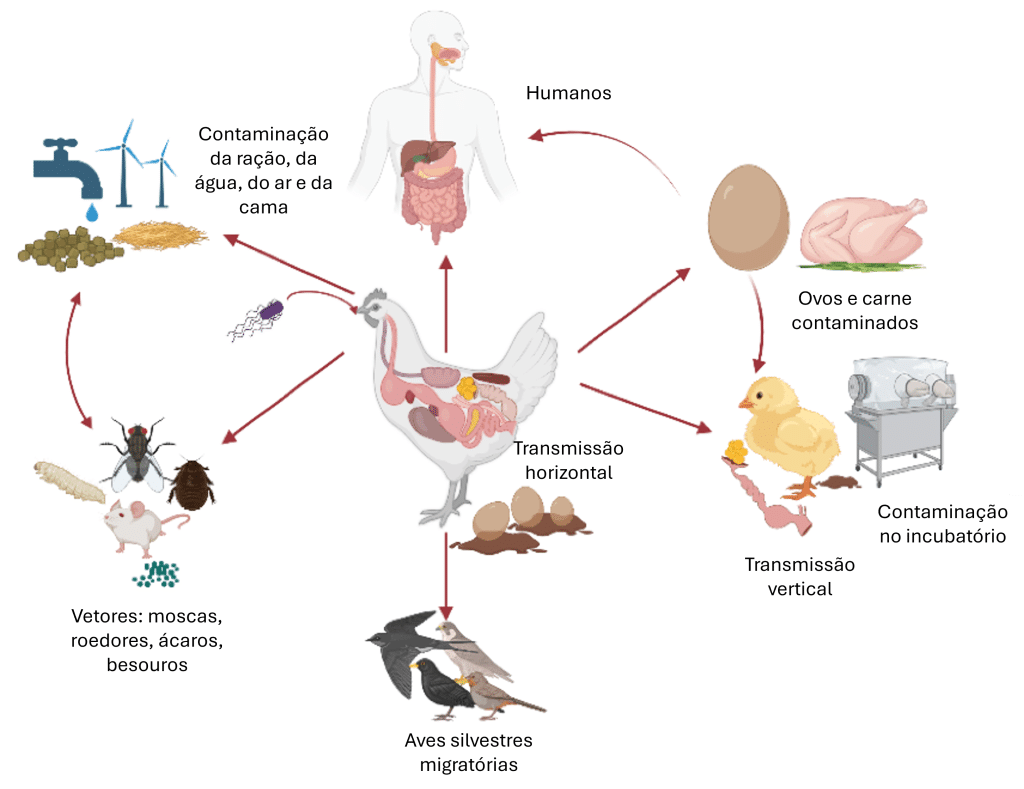
Figura 1: Um exemplo com Salmonella spp.: Uma visão geral das várias rotas de transmissão. Criado com BioRender.com
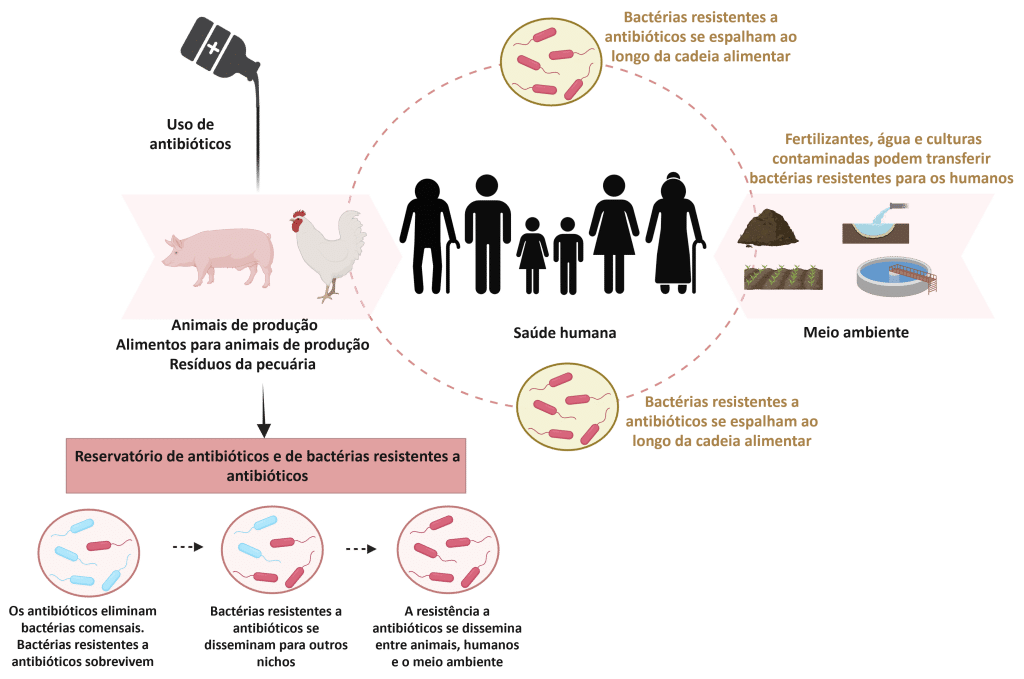
Figura 2: Resistência aos antimicrobianos (RAM) na pecuária, em humanos e no meio ambiente. Adaptado de Silva et al. (2023). Criado com BioRender.com
2. Integridade intestinal, equilíbrio da microbiota e por que a inflamação é custosa.
O trato gastrointestinal (TGI) desempenha um papel central, atuando tanto como sistema de absorção de nutrientes quanto como barreira contra patógenos (Pan, D., e Yu, Z., 2013). Sua integridade depende de uma microbiota equilibrada, respostas imunológicas eficientes e uma camada epitelial funcional (Rodríguez, 2023). A microbiota intestinal pode ser dividida em populações luminais, que residem na digesta, e populações mucosas, aderidas às células epiteliais. Ambas as comunidades interagem dinamicamente e podem ser alteradas por fatores alimentares e estressores ambientais.
Quando a integridade intestinal é comprometida, a homeostase é perdida, levando à disbiose, aumento da permeabilidade da barreira mucosa e inflamação (Dridi e Scanes, 2022; Eveaert, 2025). Inicialmente, a inflamação é protetora, mas a ativação crônica desvia energia do crescimento para a função imunológica e reparação tecidual (Teeter RG., 2007). Estima-se que, para atender aos requisitos de aminoácidos para a síntese de cada miligrama de proteína de resposta imunológica, 2,33 mg de proteína muscular são catabolizados (Reeds et al., 1994) (Figura 3).
Essa mudança aumenta as necessidades de manutenção e reduz a ingestão de ração e o ganho diário de peso, prejudicando a conversão alimentar (Latshaw, 1991; Shen et al., 2010; Marcq et al., 2011; Quinteiro-Filho et al., 2012). Distúrbios entéricos subclínicos são motivo de preocupação particular porque persistem sem serem detectados, causando perdas cumulativas em produtividade e lucratividade.
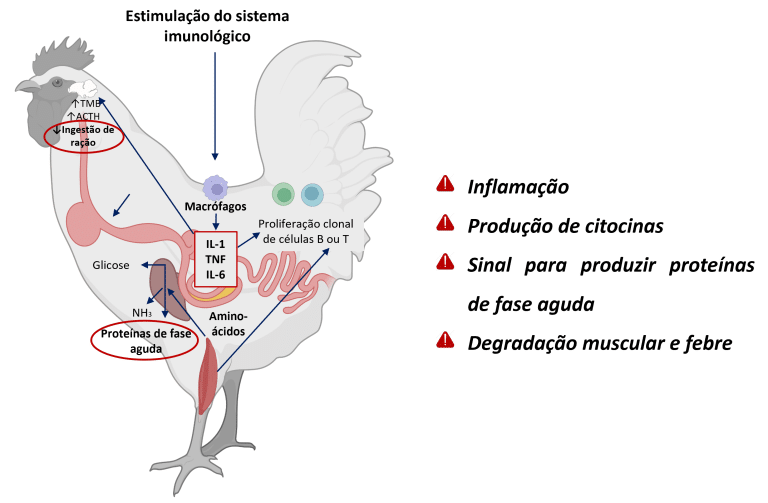
Figura 3: Cascata inflamatória em frangos: a invasão do patógeno ativa células imunes (macrófagos), desencadeando a liberação de citocinas (IL-1, TNF, IL-6). Esses sinais estimulam o fígado a produzir proteínas de fase aguda, enquanto os efeitos sistêmicos incluem a degradação das proteínas musculares para suprimento de aminoácidos e a indução de febre por regulação hipotálmica. Adaptado de Klein (2020); Dridi e Scanes (2022); Schothorst Feed Research (2024). Criado com BioRender.com
Em sistemas intensivos, onde os animais são expostos à superlotação e ao estresse, essas condições são amplificadas, criando um ambiente favorável para patógenos oportunistas.
3. Espécies patogênicas relevantes
A microbiota animal também pode abrigar espécies comensais e patogênicas (por exemplo, Escherichia coli, Salmonella enterica, Campylobacter jejuni ou Clostridium perfringens) (Dridi e Scanes, 2022). Esses patógenos são frequentemente associados a infecções entéricas ou sistêmicas e representam preocupações significativas para a saúde animal e a segurança alimentar. Além disso, sua superfície celular complexa confere resistência intrínseca a múltiplos antibióticos, complicando as estratégias de controle (Miller, 2016).
Condições comuns em sistemas intensivos de avicultura, como alta lotação, estresse ambiental e desequilíbrios alimentares, favorecem a colonização desses patógenos no trato gastrointestinal. Embora algumas infecções sejam agudas e facilmente detectáveis, muitas ocorrem de forma subclínica, reduzindo o desempenho produtivo e a eficiência alimentar sem sinais clínicos evidentes. Essa complexidade ressalta a importância de estratégias preventivas que abordem tanto a saúde intestinal quanto o controle de patógenos.
3.1. Fatores predisponentes e impacto subclínico
Vários fatores predispõem os animais ao crescimento bacteriano e a doenças. Entre eles, a coccidiose (Figura 4) é um dos principais gatilhos, danificando a mucosa intestinal e criando condições favoráveis para a proliferação de Clostridium perfringens e a produção de toxinas (Rodríguez, 2023).
A coccidiose subclínica é altamente prevalente, com relatos indicando uma média de 34,8 % em frangos de corte (Gazoni et al., 2021) e uma perda de produção estimada de 9% em sistemas europeus (Teeter RG et al., 2008). Mesmo lesões leves podem prejudicar a absorção de nutrientes, reduzir o consumo de energia e piorar a conversão alimentar (CA). Além disso, desafios tardios de coccidiose (frangos de corte entre 35 e 42 dias) têm o impacto mais severo, reduzindo o ganho médio diário em até 25% e aumentando significativamente a CA (Teeter RG et al., 2008).
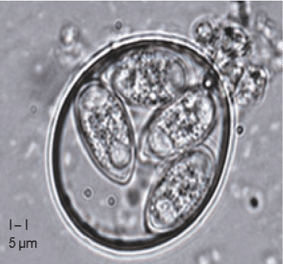
Figura 4: Oocisto esporulado de Eimeria tenella (You M, 2024)
3.2. Desempenho e impacto econômico de 2 patógenos entéricos
A E. coli patogênica aviária (APEC) e Clostridium perfringens são dois dos patógenos entéricos mais economicamente significativos na produção avícola, responsáveis respectivamente pela colibacilose e pela enterite necrótica (EN). Ambos os patógenos estão associados a desempenho de crescimento comprometido e aumento da mortalidade em lotes comerciais (Mak et al., 2022) (Figura 5).

Figura 5: E. coli patogênica aviária (APEC)
A colibacilose leva a condições sistêmicas como colisseptemia, aerossaculite, peritonite, celulite e salpingite (Mak et al., 2022).
- As taxas de mortalidade em aves jovens variam de 20 % a 53,5 %, enquanto os sobreviventes normalmente apresentam redução do peso corporal (−2 %), deterioração da CA (−2,7 %) e até 20 % menor na produção e capacidade de eclosão de ovos (Olsen et al., 2012; Nolan et al., 2020).
- No Brasil, os matadouros rejeitam até 45,2 % das carcaças devido à celulite, representando perdas anuais de aproximadamente $ 10 milhões (Fallavena et al., 2000).
- Além disso, cepas de APEC são comumente associadas a altos níveis de resistência antimicrobiana, complicando estratégias de tratamento e controle (Van Limbergen et al., 2020).
Clostridium perfringens causa enterite necrótica (EN), que pode ser clínica ou subclínica (Hargis, 2023) (Figura 6).
- Essa bactéria Gram-positiva é um organismo comensal, presente em 75–90 % das aves, mas sob condições favoráveis pode proliferar e causar enterite necrótica.
- Na avicultura, a EN clínica pode resultar em taxas diárias de mortalidade de até 1 %.
- A EN subclínica, estimada em 20 % de prevalência, pode reduzir o peso corporal em 12 % e aumentar a CA em 10,9 % (Skinned et al., 2010; Wade e Keyburn, 2015).
- O impacto econômico global da EN é estimado entre 5 e 6 bilhões de dólares por ano (Wade e Keyburn, 2015).
Esses números destacam o custo oculto das infecções subclínicas, que muitas vezes permanecem não diagnosticadas, mas comprometem significativamente a lucratividade.
A redução dos antibióticos na produção animal impulsionou a busca por alternativas, incluindo matérias-primas funcionais que possam contribuir para a modulação microbiana e promover a integridade intestinal.
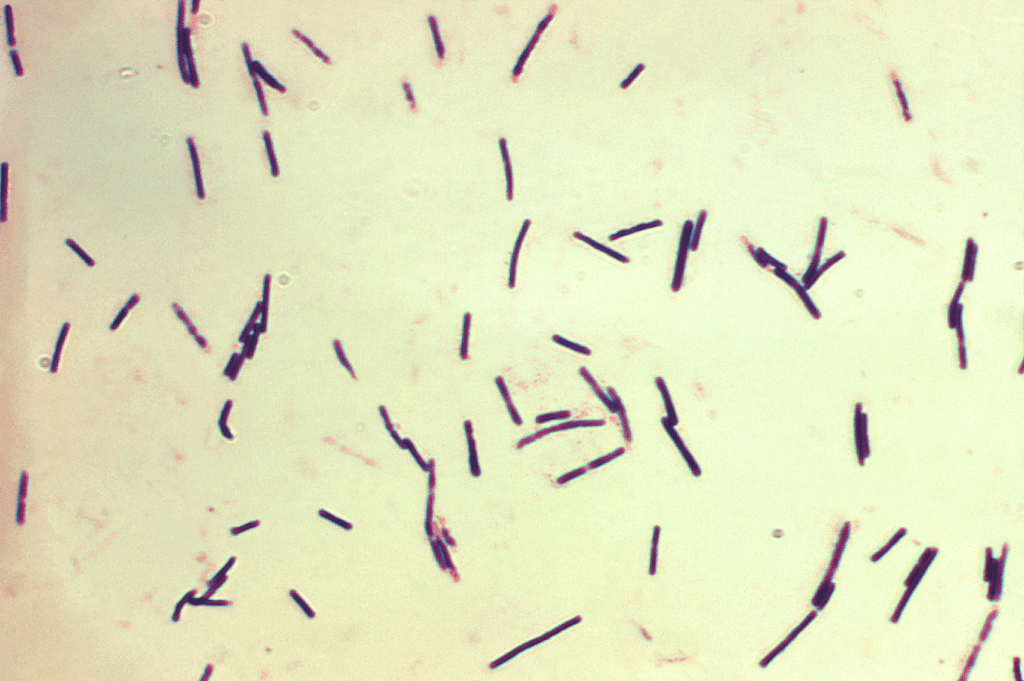
Figura 6: Clostridium perfringens
4. Efeitos do fosfato funcional: Humofosfato de cálcio e seu Impacto na Proliferação Bacteriana
O humofosfato de cálcio (HumIPHORA) é um fosfato funcional, obtido pela reação do ácido fosfórico, cálcio e substâncias húmicas (SH). Seu principal mecanismo de ação é limitar a formação de complexos insolúveis. Além disso, sua composição também traz benefícios secundários para a saúde intestinal.
Na nutrição animal, as SH demonstraram propriedades antimicrobianas, anti-inflamatórias e imunomoduladoras. Sua capacidade de formar camadas protetoras sobre o epitélio intestinal ajuda a prevenir a adesão e a translocação de bactérias e toxinas patogênicas, contribuindo para a melhoria da integridade da mucosa (Arif et al., 2019; Domínguez-Negrete et al., 2019; Zanin et al., 2019). A integração de substâncias húmicas em matrizes minerais como o humofosfato de cálcio pode aumentar sua atividade biológica, apoiando a saúde intestinal e o equilíbrio microbiano em animais monogástricos.
Um ensaio in vitro foi realizado no ‘Centre Mondial de l’Innovation (CMI)’ utilizando o método spot para avaliar o potencial antimicrobiano do HumIPHORA em comparação com uma fonte inorgânica convencional de fosfato para alimentação animal (fosfato monocálcico, MCP) (Figura 7).
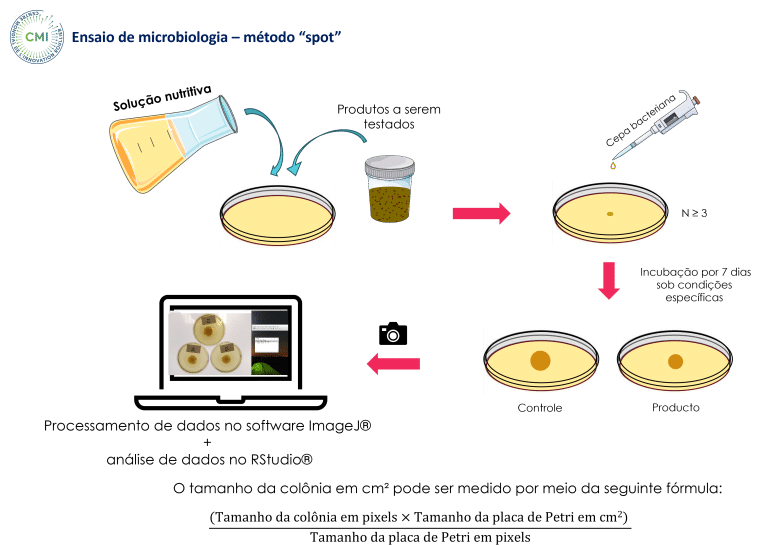
Figura 7: Ensaio microbiológico – método “spot” realizado em nosso ensaio in vitro (CMI, 2025)
HumIPHORA mostrou efeitos inibitórios maiores contra Escherichia coli e Clostridium perfringens em comparação com MCP (Figura 8). Esses resultados reforçam a relevância microbiológica do humofosfato de cálcio e são consistentes com observações prévias in vivo em suínos, onde uma incidência menor de diarreia foi relatada. Além disso, ensaios de campo sugerem que o uso de HumIPHORA pode ter um efeito positivo na mortalidade das aves. Por exemplo, em um ensaio com frangos de corte sob estresse térmico, a mortalidade acumulada do dia 0 ao 42 foi de 9,3 % com o grupo HumIPHORA contra 14,5 % com fosfato dicálcico (DCP). Esse efeito também pode ser observado em pintinhos nos primeiros dias de vida, quando são fisiologicamente imaturos e mais vulneráveis ao estresse oxidativo (Baeza e Coudert, 2023).
HumIPHORA apresenta atividade antimicrobiana promissora e potenciais benefícios em animais monogástricos. Esses achados abrem perspectivas para validação adicional por meio de ensaios controlados in vivo e estudos experimentais adicionais de desempenho produtivo.
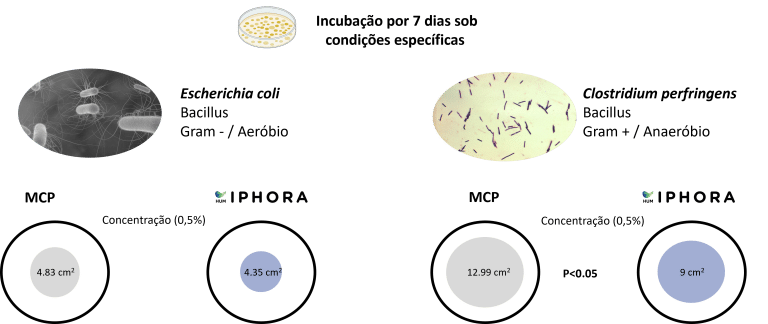
Figura 8: Efeito do HumIPHORA no crescimento bacteriano (E. coli e C. perfringens)
