1. Fonction et pertinence de l'acide phytique
L’acide phytique (InsP6) et ses sels (phytate) sont des composés naturels présents dans les ingrédients végétaux, étant l’une des principales formes de phosphore stockée dans les graines et les grains des céréales. De ce fait, le phytate est présent dans les régimes monogastriques, qui manquent d’enzymes endogènes capables de le dégrader efficacement.
L’acide phytique présente des défis nutritionnels car il a une forte tendance à se lier aux minéraux et aux protéines, réduisant ainsi leur biodisponibilité.
Comprendre sa structure, sa fonction et son impact est essentiel pour des pratiques alimentaires durables.
2. Structure de l'acide phytique
L’acide phytique, chimiquement connu sous le nom de myo-inositol hexakisphosphate (IP6), est formé d’un cycle myo-inositol avec 6 groupes phosphate liés un sur chacun des atomes de carbone (Figure 1) (FEDNA, 2021).
Dans les ingrédients végétaux, l’acide phytique existe rarement sous forme d’acide libre. Au lieu de cela, il forme des sels avec des minéraux tels que le calcium, le magnésium et le potassium, ou même avec des protéines et des amidons, formant des structures plus complexes. Ces sels sont connus sous le nom de phytates ou de phytine (Outchkourov et Petkov, 2019 ; Humer et Schwarz, 2014).
La molécule d’acide phytique possède 12 protons remplaçables, ce qui lui confère un potentiel électronégatif élevé à un pH proche de la neutralité. Cela rend la molécule très réactive et instable sous sa forme libre (Humer et Schwarz, 2014) (Figures 1 et 2).
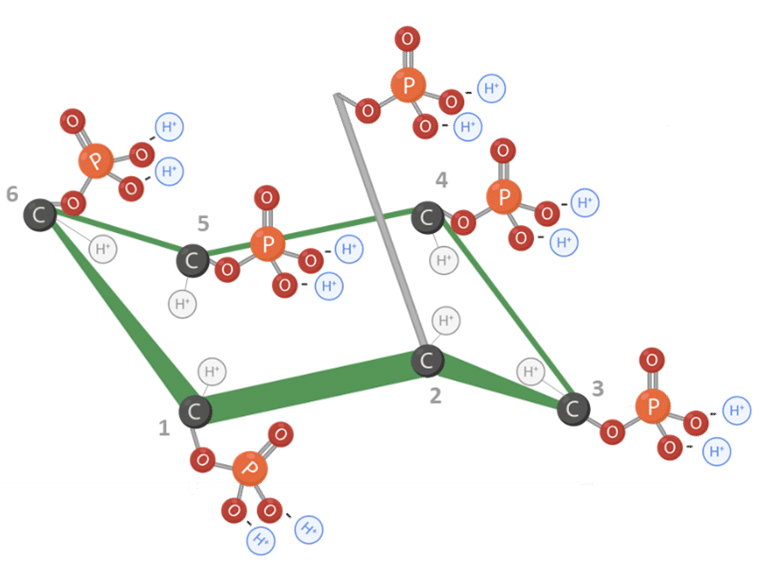
Figure 1 : Structure moléculaire de l’acide phytique. Adapté de Vieira et al., 2018. Créé en BioRender.com
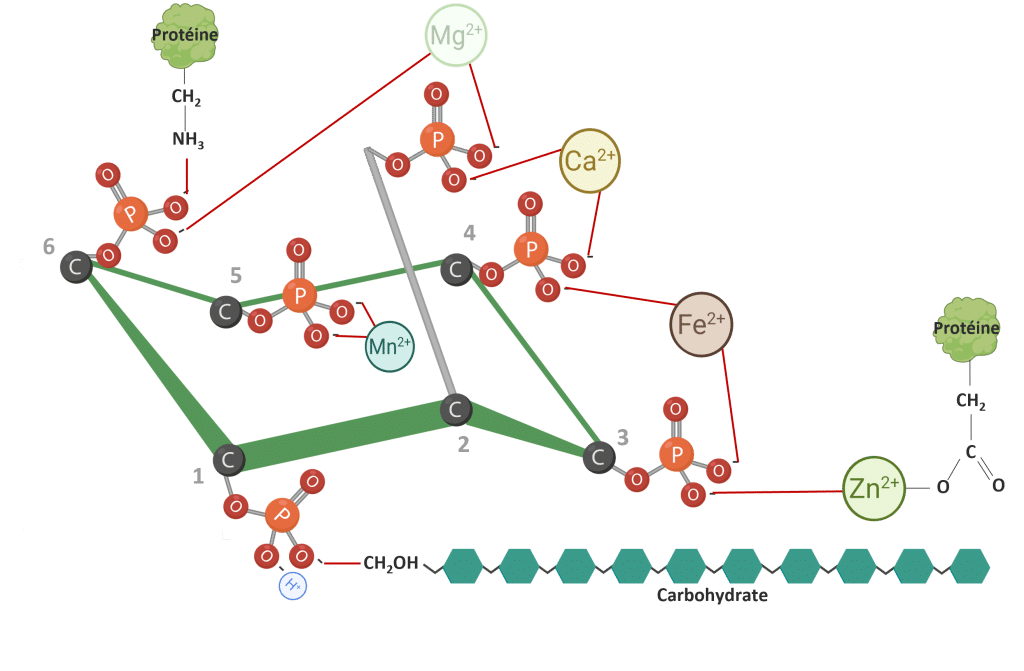
Figure 2 : IP6 lié à différents nutriments. Adapté de Vieira et al., 2018. Créé en BioRender.com
3. Présence de phytate dans les matières premières
Dans les graines de végétales, l’acide phytique est la principale forme de stockage du phosphore. Il s’accumule au cours du développement des graines et est stocké dans des vacuoles spécialisées, appelées globoïdes (Figure 3) (Bohn et al., 2007 ; Kumar et al., 2019).
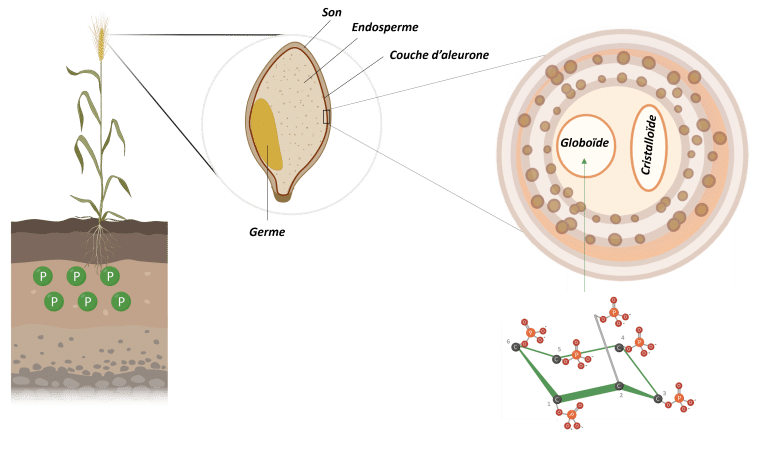
Figure 3 : Stockage des phytates dans les granules de blé. Adapté de Freed et al., 2020. Créé en BioRender.com.
Les concentrations de phytates varient considérablement entre les ingrédients des aliments pour animaux. Environ 50 à 80 % du phosphore total dans les céréales et les oléagineux se présente sous forme d’acide phytique ou de phytate (Kavitha, 2016 ; Kumar et al., 2019).
Les régimes monogastriques contiennent environ 0,2 à 0,3 % de phosphore lié au phytate (InsP6-P), variant selon la matière première utilisée et ses conditions de culture et de transformation (tableau 1) (Rodehutscord et al., 2016 ; Outchkourov et Petkov, 2019).
Tableau 1 : Teneur totale en phosphore (P) et rapport P-phytate (InsP6-P) en fonction des différentes matières premières utilisées dans les aliments pour animaux

Compte tenu de la variabilité de la composition du phytate et de sa sensibilité à l’hydrolyse dans différentes matières premières pour l’alimentation animale, il devient essentiel de comprendre comment le phytate se décompose.
4. Dégradation des phytates : phytases et activité microbienne
L’hydrolyse des phytates implique l’élimination progressive des groupes phosphates de la molécule InsP6, ce qui donne des phosphates d’inositol de plus fiable degré tels que InsP5, InsP4 et InsP3. Ce processus peut se produire par le biais de 3 sources principales d’activité de la phytase : les phytases végétales intrinsèques, les phytases microbiennes associées à la muqueuse intestinale et la supplémentation en phytases exogènes (Humer et Schwarz, 2014 ; Rodehutscord et Rosenfelder 2016).
4.1. Phytases végétales
L’activité endogène de la phytase chez les plantes joue un rôle clé dans la dégradation initiale du phytate. Les céréales telles que le seigle, le blé, l’orge et leurs sous-produits présentent des niveaux élevés de phytase endogène, tandis que les légumineuses et les oléagineux présentent généralement une activité plus faible (FEDNA, 2021). Cependant, les phytases végétales sont thermolabiles, par exemple, la pelletisation à des températures supérieures à 85 °C peut inactiver jusqu’à 74 % de l’activité de la phytase (Outchkourov & Petkov, 2019).
4.2. Effet du tractus gastro-intestinal de la volaille (GIT)
Le tube digestif joue un rôle dans la dégradation du phytate. Le jabot, bien qu’il ne soit pas un site d’absorption important, peut initier l’hydrolyse du phytate par l’activité microbienne. Bien que la courte durée de rétention du digesta puisse limiter l’action enzymatique (Kerr et al., 2000 ; Witzig et al., 2015).
Dans le cæcum, il existe une communauté microbienne très diversifiée avec une activité phytase substantielle. Cependant, malgré le potentiel enzymatique, la pertinence nutritionnelle de l’hydrolyse des phytates dans le cæcum est limitée (Zeller et al., 2015), et le phosphore libéré dans le caecum est principalement excrété en raison d’un manque d’absorption post-iléale (Son et al., 2002).
4.3. Phytases microbiennes exogènes
L’utilisation de phytases microbiennes exogènes est devenue l’une des stratégies les plus efficaces pour augmenter la biodisponibilité du phosphore dans la nutrition monogastrique (Kumar & Sinha, 2018). L’estomac est le principal site d’activité de la phytase en raison de son faible pH. Une fois que la nourriture passe dans l’intestin, l’activité de la phytase diminue en raison de la solubilité réduite des phytates et des conditions de pH moins favorables (Kumar et al., 2019 ; Humer et Schwarz, 2014).
L’efficacité de la phytase dépend de la stabilité du pH et de la température, de l’affinité du substrat, de la résistance à la protéolyse, du temps de rétention gastro-intestinale et de facteurs alimentaires tels que le rapport Ca 😛 et la concentration en phytates (Kumar et al., 2019). Malgré les progrès de la technologie de la phytase, la déphosphorylation complète de l’IP6 jusqu’au myo-inositol est rarement obtenue (Menezes-Blackburn et al., 2015).
Comprendre les stratégies enzymatiques est essentiel non seulement pour améliorer l’utilisation du phosphore, mais aussi pour atténuer son effet antinutritionnel.
5. Interactions du phytate avec les nutriments
En plus de son rôle de source de phosphore organique, le phytate peut présenter des effets antinutritionnels qui compromettent l’absorption et l’utilisation des nutriments.
5.1. Interactions phytates-minéraux
Le phytate peut interagir avec les minéraux essentiels (Figure 4). Ces interactions entraînent la formation de complexes phytates-minéraux insolubles qui sont mal absorbés dans l’intestin, réduisant la biodisponibilité des minéraux (Kumar et Sinha, 2018 ; Outchkourov et Petkov, 2019).
Selon Cheryan (1980), la liaison minérale du phytate suit un ordre général de stabilité : Zn²⁺ >Cu²⁺ > Ni²⁺ > Co²⁺ > Mn²⁺ > Ca²⁺ > Fe²⁺. Cette hiérarchie reflète les différents degrés auxquels les différents minéraux sont affectés par la chélation des phytates.
Afin d’obtenir une solubilité suffisante des minéraux et des esters d’acide phytique à un pH plus élevé, une hydrolyse précoce du phytate peut être nécessaire, idéalement dans l’estomac, pour réduire la formation de complexes et augmenter l’absorption des minéraux.
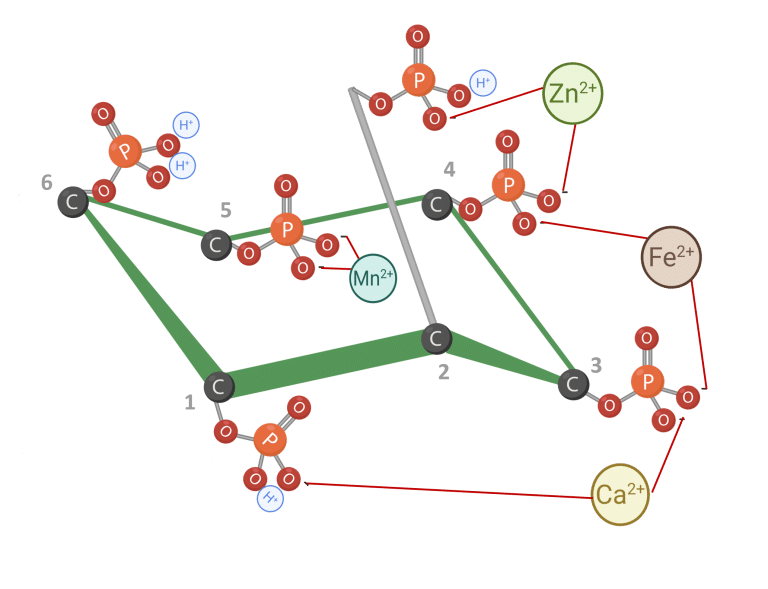
Figure 4 : IP6 lié aux cations. Adapté de Vieira et al. (2018). Créé en BioRender.com
5.2. Interactions phytate-protéine
Le phytate peut nuire à l’utilisation des protéines par la formation de complexes phytate-protéine (Humer et al., 2014). À de faibles valeurs de pH, le phytate interagit directement avec les acides aminés basiques. À mesure que le pH augmente dans l’intestin grêle, le phytate peut former des liaisons ternaires avec des protéines et des cations multivalents, comme le calcium (Figure 5) (Kumar et al., 2019 ; Reddy et Salunkhe, 1981 ; Nissar et al., 2017 ; Humer et al., 2014).
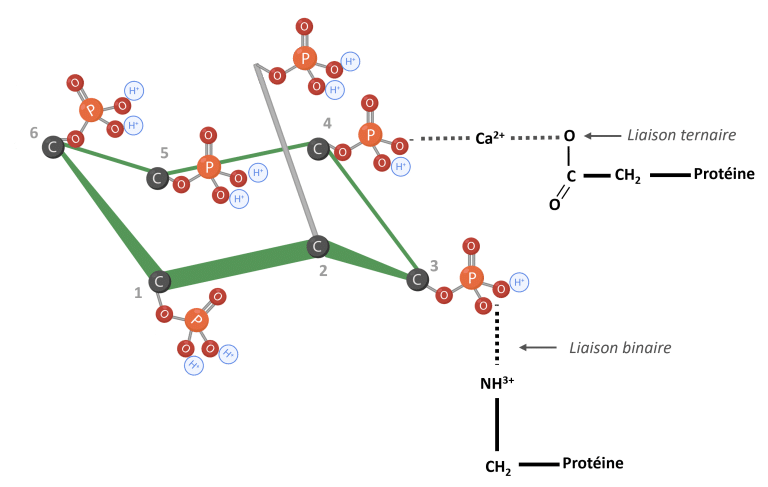
Figure 5 : IP6 lié aux protéines. Adapté de Morales et al. (2016). Créé en BioRender.com
5.3. Interactions nutritionnelles plus larges du phytate
Le phytate peut interagir avec les glucides en formant des complexes d’amidon (Figure 6) (Kumar et al., 2019). De même, le phytate peut également interagir avec les lipides, réduisant ainsi l’utilisation de l’énergie (Humer et Schwarz, 2014 ; Camden et al., 2001).
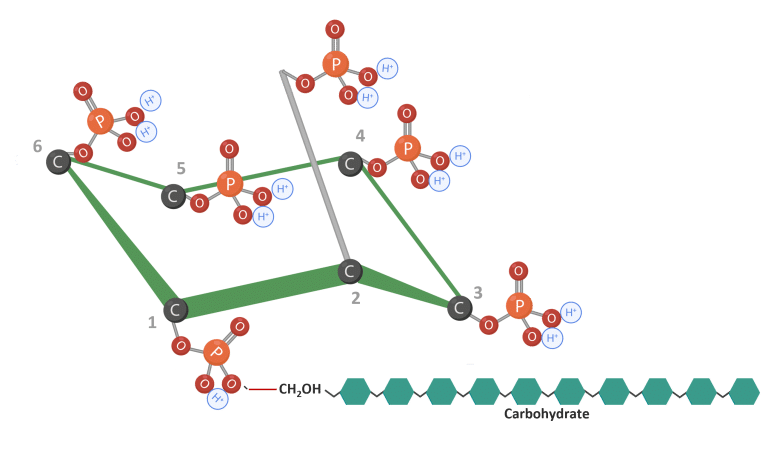
Figure 6 : IP6 lié aux glucides. Adapté de Vieira et al. (2018) ; Oatway et al. (2001). Créé en BioRender.com
Le phytate limite la biodisponibilité des nutriments essentiels, ce qui affecte l’efficacité alimentaire. La supplémentation en phosphate inorganique répond aux besoins en phosphore mais ne contrecarre pas les effets antinutritionnels du phytate (Outchkourov & Petkov, 2019). Cependant, de nouvelles générations de phosphates fonctionnels ont vu le jour pour réduire la formation de complexes insolubles.
6. Matière première fonctionnelle innovante : l'humophosphate de calcium – limitant les interactions avec le phytate
L’un des défis restants dans la dégradation des phytates est de minimiser la formation de complexes insolubles. Dans ce contexte, l’humophosphate de calcium (HumIPHORA) représente une approche innovante et fonctionnelle. Il combine du phosphore, du calcium et des substances humiques – des composés organiques aux propriétés chélatrices qui peuvent interagir avec les ions du tractus gastro-intestinal.
HumIPHORA a la capacité de se lier aux cations divalents, tels que l’excès de calcium, réduisant ainsi l’interaction avec l’acide phytique. Cela limite la formation de complexes calcium-phytate insolubles et maintient le phytate sous une forme plus hydrolysable. Par conséquent, l’action de la phytase est facilitée, améliorant la libération et l’absorption du phosphore des ingrédients végétaux.
Contrairement aux sources de phosphate conventionnelles, HumIPHORA interagit avec les nutriments du tractus gastro-intestinal et réduit les effets antinutritionnels du calcium et du phytate. Son inclusion dans l’alimentation des volailles favorise la dégradation du phytate et améliore l’absorption des nutriments – en particulier le phosphore et le calcium, essentiels à la croissance et au développement du squelette.
Un essai expérimental mené en collaboration avec l’Université de São Paulo confirme cet effet, montrant une teneur en cendres tibiales significativement plus élevée chez les poulets de chair nourris avec des régimes contenant HumIPHORA par rapport à ceux contenant du phosphate monocalcique (MCP) (Figure 7). La teneur en cendres du tibia est un indicateur fiable de la minéralisation osseuse, reflétant la rétention de calcium et de phosphore et contribuant au développement squelettique.
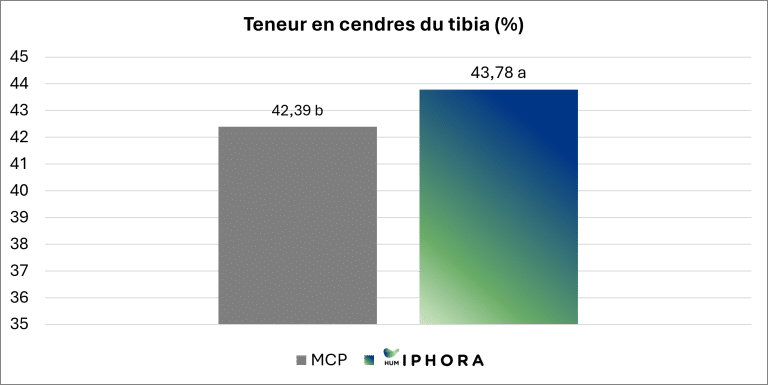
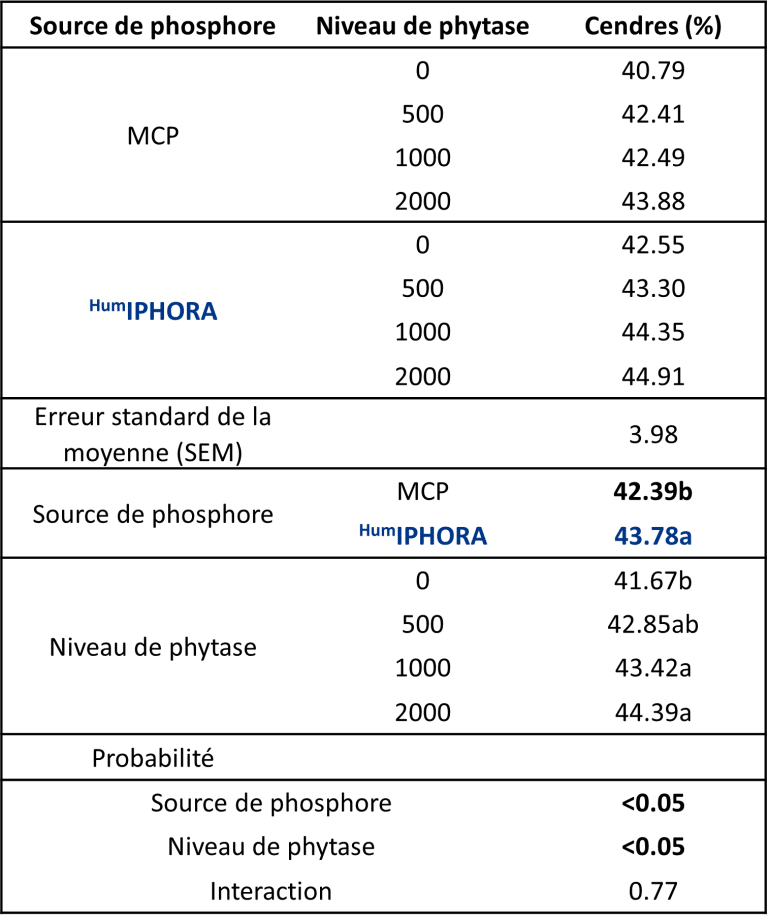
Figure 7 : Effet de l’inclusion de HumIPHORA dans l’alimentation des poulets de chair sur la teneur en cendres du tibia.
