1. Défi des maladies bactériennes et de la résistance aux antimicrobiens
Les infections bactériennes représentent l’un des défis les plus persistants dans la production monogastrique, affectant à la fois la santé animale et la sécurité alimentaire (Mak et al., 2022). Une large gamme d’agents pathogènes (par exemple, Escherichia coli, Salmonella enterica, Campylobacter jejuni/coli, Clostridium perfringens, etc.) peuvent coloniser le tractus gastro-intestinal ou d’autres tissus (Mancabelli et al., 2016 ; Oakley et al., 2014 ; Kumar et al., 2018).
Ces organismes varient en pathogénicité et en impact : certains compromettent principalement l’intégrité intestinale et l’absorption des nutriments, tandis que d’autres provoquent des infections systémiques ou présentent des risques zoonotiques (Figure 1) par la contamination des carcasses et des œufs.
Historiquement, les antibiotiques étaient largement utilisés pour contrôler ces maladies et améliorer la productivité (Mak et al., 2022). Cependant, ces pratiques ont contribué à l’émergence et à la propagation de la résistance aux antimicrobiens (RAM), désormais reconnue comme une menace mondiale pour la santé animale et humaine (Figure 2).
Alors que les systèmes de production animale réduisent l’utilisation d’antimicrobiens pour répondre aux préoccupations concernant la RAM (RAM), les producteurs font face à de nouveaux défis : les infections bactériennes subcliniques restent souvent indétectables, mais elles détournent les nutriments vers des réponses immunitaires et la réparation tissulaire, réduisant ainsi l’efficacité alimentaire et la rentabilité (Shen et al., 2010 ; Marcq et al., 2011 ; Quinteiro-Filho et al., 2012 ; Remus et al., 2014). Cette réalité souligne la nécessité de stratégies intégrées qui maintiennent la santé intestinale et contrôlent les populations bactériennes sans recourir aux antibiotiques.
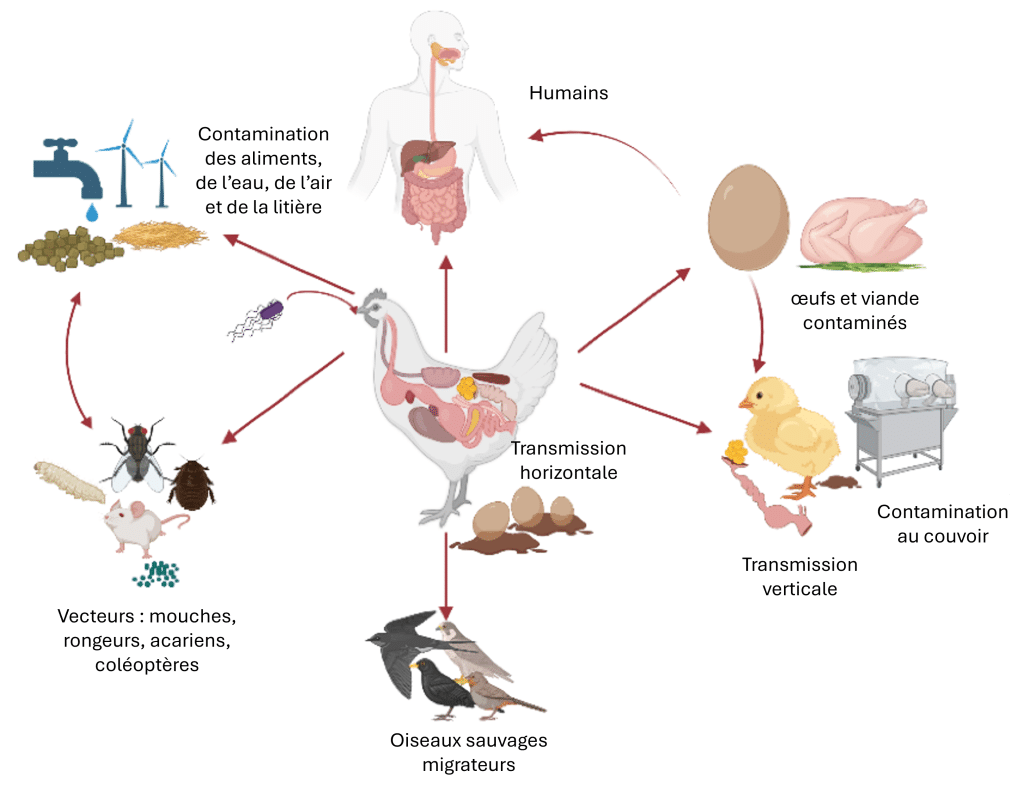
Figure 1 : Un exemple avec Salmonella spp. : Un aperçu des différentes voies de transmission. Créé avec BioRender.com
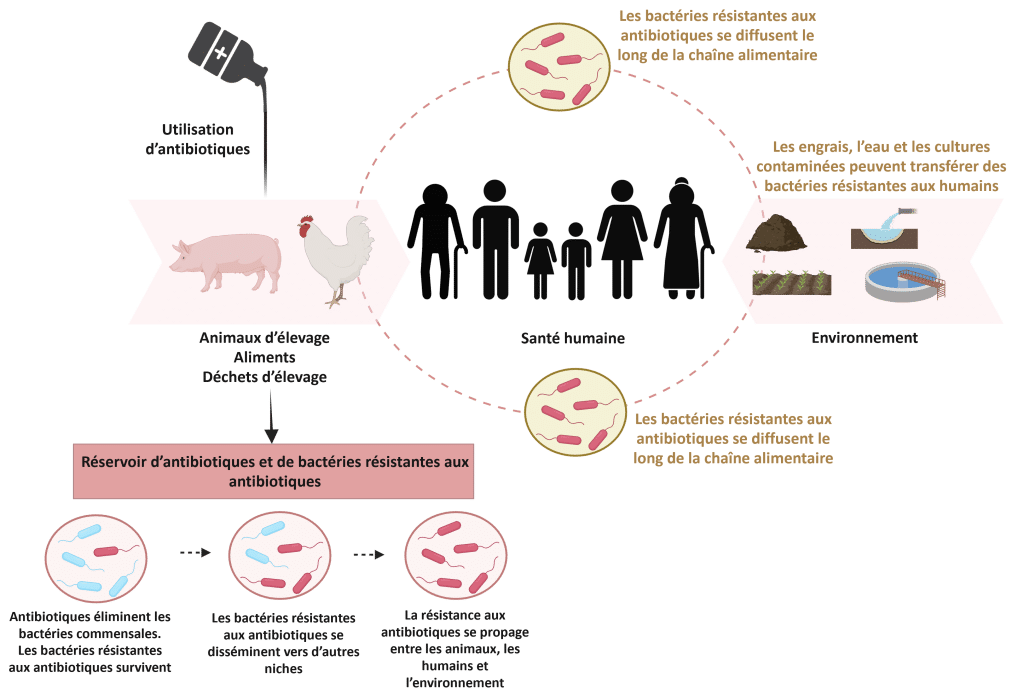
Figure 2 : Résistance aux antimicrobiens (RAM) chez les animaux, les humains et l’environnement. Adapté de Silva et al. (2023). Créé avec BioRender.com
2. L'intégrité intestinale, l'équilibre du microbiote et pourquoi l'inflammation est coûteuse.
Le tractus gastro-intestinal (TGI) joue un rôle central, agissant à la fois comme système d’absorption des nutriments et comme barrière contre les agents pathogènes (Pan, D., et Yu, Z., 2013). Son intégrité dépend d’un microbiote équilibré, de réponses immunitaires efficaces et d’une couche épithéliale fonctionnelle (Rodríguez, 2023). Le microbiote intestinal peut être divisé en populations luminales, qui résident dans le contenu digestif, et en populations muqueuses, adhérentes aux cellules épithéliales. Les deux communautés interagissent de manière dynamique et peuvent être modifiées par des facteurs alimentaires et stresseurs environnementaux.
Lorsque l’intégrité intestinale est compromise, l’homéostasie est perdue, entraînant une dysbiose, une perméabilité accrue de la barrière muqueuse et une inflammation (Dridi et Scanes, 2022 ; Eveaert, 2025). Au départ, l’inflammation est protectrice, mais l’activation chronique détourne l’énergie de la croissance vers la fonction immunitaire et la réparation tissulaire (Teeter RG., 2007). On estime que, afin de répondre aux besoins en acides aminés pour la synthèse de chaque milligramme de protéine de réponse immunitaire, 2,33 mg de protéine musculaire sont catabolisés (Reeds et al., 1994) (Figure 3).
Ce changement augmente les besoins d’entretien et réduit la consommation alimentaire et le gain de poids quotidienne, altère l’efficacité de conversion alimentaire (Latshaw, 1991 ; Shen et al., 2010 ; Marcq et al., 2011 ; Quinteiro-Filho et al., 2012). Les troubles entériques subcliniques sont particulièrement préoccupants car ils persistent sans être détectés, entraînant des pertes cumulatives en productivité et en rentabilité.
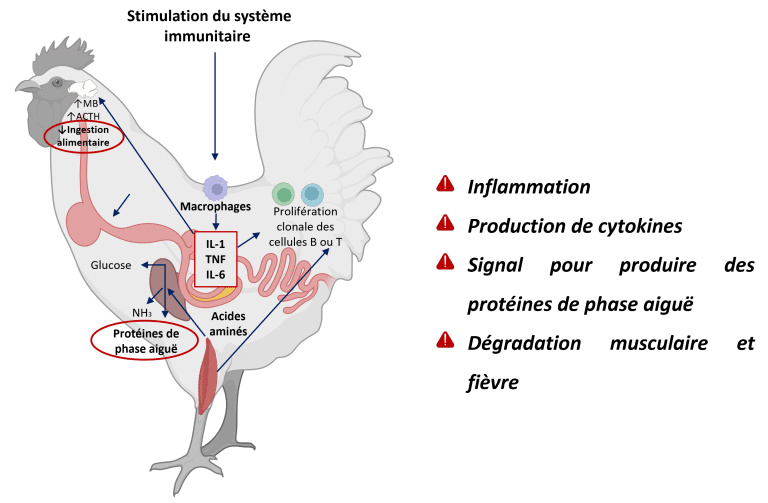
Figure 3 : Cascade inflammatoire chez les poulets : l’invasion du pathogène active les cellules immunitaires (macrophages), déclenchant la libération de cytokines (IL-1, TNF, IL-6). Ces signaux stimulent le foie à produire des protéines en phase aiguë, tandis que les effets systémiques incluent la dégradation des protéines musculaires pour l’apport en acides aminés et l’induction de la fièvre par régulation hypothalamique. Adapté de Klein (2020) ; Dridi et Scanes (2022) ; Schothorst Feed Research (2024). Créé avec BioRender.com
Dans les systèmes intensifs, où les animaux sont exposés à la surpopulation et au stress, ces conditions sont amplifiées, créant un environnement favorable aux agents pathogènes opportunistes.
3. Espèces pathogènes d’intérêt
Le microbiote animal peut également abriter des espèces commensales et pathogènes (par exemple, Escherichia coli, Salmonella enterica, Campylobacter jejuni ou Clostridium perfringens) (Dridi et Scanes, 2022). Ces agents pathogènes sont fréquemment associés à des infections entériques ou systémiques et représentent des préoccupations majeures pour la santé animale et la sécurité alimentaire. De plus, leur surface cellulaire complexe confère une résistance intrinsèque à plusieurs antibiotiques, compliquant les stratégies de contrôle (Miller, 2016).
Les conditions courantes dans les systèmes avicoles intensifs, telles que la forte densité, le stress environnemental et les déséquilibres alimentaires, favorisent la colonisation de ces agents pathogènes dans le tractus gastro-intestinal. Bien que certaines infections soient aiguës et facilement détectables, beaucoup surviennent de manière subclinique, réduisant la performance de production et l’efficacité de l’alimentation sans signes cliniques évidents. Cette complexité souligne l’importance de stratégies préventives qui traitent à la fois de la santé intestinale et du contrôle des agents pathogènes.
3.1. Facteurs prédisposants et impact subclinique
Plusieurs facteurs prédisent les animaux à la prolifération bactérienne et aux maladies. Parmi ceux-ci, les coccidies (Figure 4) sont un déclencheur majeur, endommageant la muqueuse intestinale et créant des conditions favorables à la prolifération de Clostridium perfringens et à la production de toxines (Rodríguez, 2023).
La coccidiose subclinique est très répandue, les rapports indiquant une moyenne de 34,8 % dans les poulets de chair (Gazoni et al., 2021) et une perte de production estimée à 9 % dans les systèmes européens (Teeter RG et al., 2008). Même des blessures légères peuvent altérer l’absorption des nutriments, réduire l’apport en énergie et aggraver l’indice de conversion (IC). De plus, les défis tardifs avec la coccidie (poulets de 35 à 42 jours) ont l’impact le plus sévère, réduisant le gain quotidien moyen jusqu’à 25 % et augmentant significativement l’IC (Teeter RG et al., 2008).
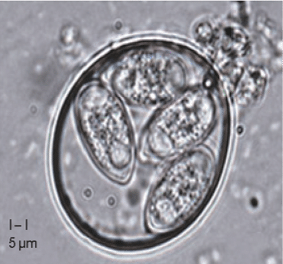
Figure 4 : Oocyste sporulé d’Eimeria tenella (You M, 2024)
3.2. Performance et impact économique de 2 pathogènes entériques
L’E. coli pathogène aviaire (APEC) et Clostridium perfringens sont deux des agents pathogènes entériques les plus importants sur le plan économique dans la production avicole, responsables respectivement de la colibacillose et de l’entérite nécrotique (EN). Les deux pathogènes sont associés à une performance de croissance altérée et à une mortalité accrue dans les lots commerciaux (Mak et al., 2022) (Figure 5).

Figure 5 : E. coli pathogène aviaire (APEC)
La colibacillose entraîne des affections systémiques telles que la colisepticémie, l’aérosaculite, la péritonite, la cellulite et la salpingite (Mak et al., 2022).
- Les taux de mortalité chez les jeunes oiseaux varient de 20 % à 53,5 %, tandis que les survivants présentent généralement une réduction du poids corporel (−2 %), une détérioration de l’IC (−2,7 %) et jusqu’à 20 % de moins production d’œufs et de capacité d’éclosion (Olsen et al., 2012 ; Nolan et al., 2020).
- Au Brésil, les abattoirs rejettent jusqu’à 45,2 % des carcasses à cause de la cellulite, ce qui représente des pertes annuelles d’environ 10 millions de dollars USD (Fallavena et al., 2000).
- De plus, les souches APEC sont souvent associées à des niveaux élevés de résistance aux antimicrobiens, compliquant les stratégies de traitement et de contrôle (Van Limbergen et al., 2020).
Clostridium perfringens provoque une entérite nécrotique (EN), qui peut être clinique ou subclinique (Hargis, 2023) (Figure 6).
- Cette bactérie Gram-positive est un organisme commensal, présente chez 75 à 90 % des volailles, mais dans des conditions favorables, elle peut proliférer et provoquer une entérite nécrotique.
- Chez la volaille, la EN clinique peut entraîner des taux de mortalité journaliers allant jusqu’à 1 %.
- La NE subclinique, estimée à 20 % de prévalence, peut réduire le poids corporel de 12 % et augmenter l’IC de 10,9 % (Skinned et al., 2010 ; Wade et Keyburn, 2015).
- L’ impact économique mondial du NE est estimé entre 5 et 6 milliards de dollars par an (Wade et Keyburn, 2015).
Ces chiffres soulignent le coût caché des infections subcliniques, qui restent souvent non diagnostiquées mais compromettent considérablement la rentabilité
La réduction des antibiotiques dans la production animale a poussé la recherche d’alternatives, y compris des matières premières fonctionnelles pouvant contribuer à la modulation microbienne et favoriser l’intégrité intestinale.
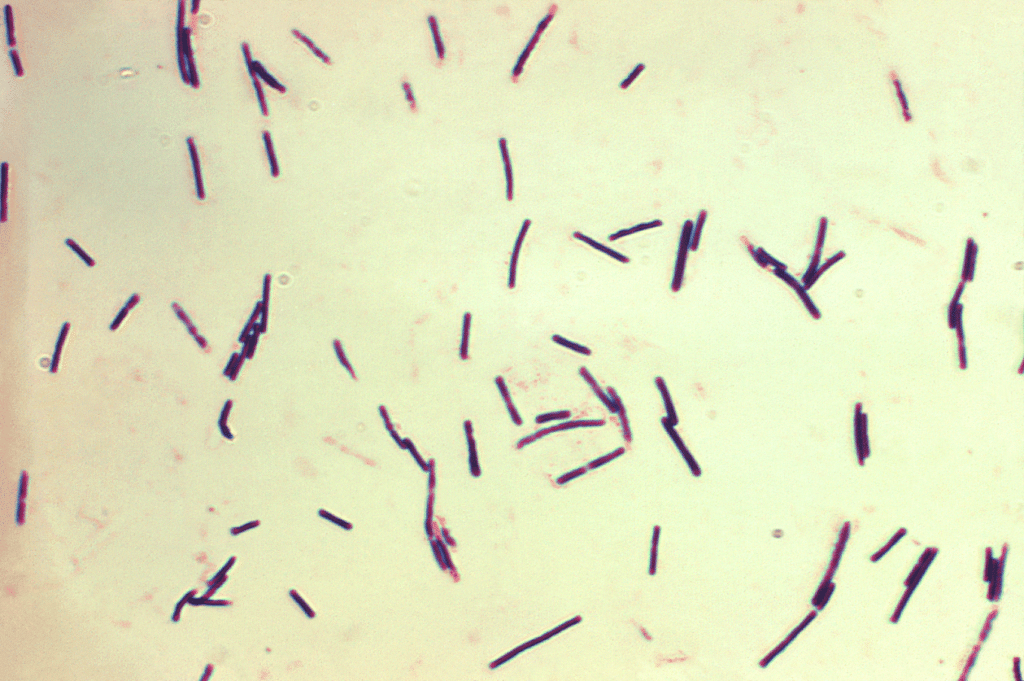
Figure 6 : Clostridium perfringens
4. Effets du phosphate fonctionnel : L’humophosphate de calcium et son impact sur la prolifération bactérienne
Le humophosphate de calcium (HumIPHORA) est un phosphate fonctionnel, obtenu par la réaction de l’acide phosphorique, du calcium et des substances humiques (SH). Son principal mécanisme d’action est de limiter la formation de complexes insolubles. Au-delà de cela, sa composition apporte également des bénéfices secondaires pour la santé intestinale.
En nutrition animale, les SH ont démontré des propriétés antimicrobiennes, anti-inflammatoires et immunomodulatrices. Leur capacité à former des couches protectrices sur l’épithélium intestinal aide à prévenir l’adhésion et la translocation de bactéries et toxines pathogènes, contribuant ainsi à une amélioration de l’intégrité de la muqueuse (Arif et al., 2019 ; Domínguez-Negrete et al., 2019 ; Zanin et al., 2019). L’intégration de substances humiques dans des matrices minérales telles que le humophosphate de calcium peut renforcer leur activité biologique, soutenant la santé intestinale et l’équilibre microbien chez les animaux monogastriques.
Un test in vitro a été réalisé au Centre Mondial de l’Innovation (CMI) en utilisant la méthode ponctuelle pour évaluer le potentiel antimicrobien d’HumIPHORA face à une source inorganique conventionnelle de phosphate pour l’alimentation animale (phosphate monocalcique, MCP) (Figure 7).
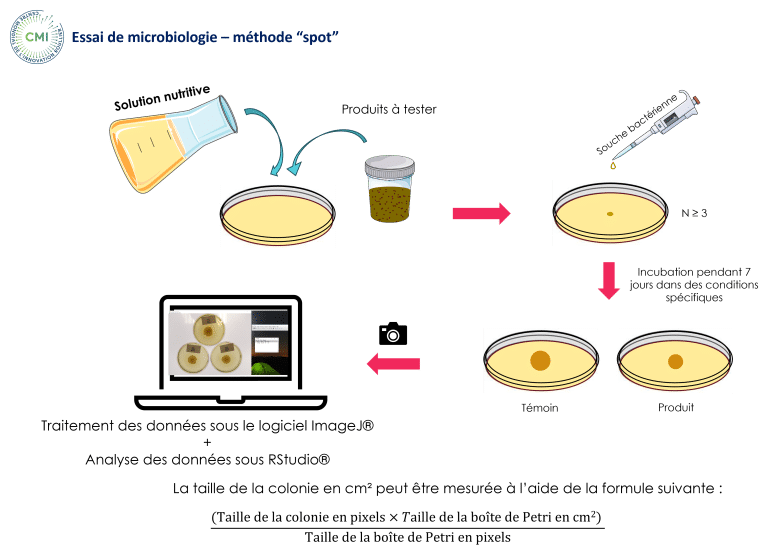
Figure 7 : Analyse microbiologique – méthode « spot » réalisée dans notre test in vitro (CMI, 2025)
HumIPHORA a montré des effets inhibiteurs plus marqués contre Escherichia coli et Clostridium perfringens comparé au MCP (Figure 8). Ces résultats renforcent la pertinence microbiologique de l’humophosphate de calcium et sont cohérents avec des observations in vivo antérieures chez les porcs, où une incidence plus faible de diarrhée a été rapportée. De plus, des essais sur le terrain suggèrent que l’utilisation de HumIPHORA pourrait avoir un effet positif sur la mortalité des volailles. Par exemple, dans un essai avec des poulets de chair soumis à un stress thermique, la mortalité cumulative du jour 0 au 42e jour était de 9,3 % avec le groupe HumIPHORA contre 14,5 % avec le phosphate dicalcique (DCP). Cet effet peut également être observé chez les poussins durant les premiers jours de vie, lorsqu’ils sont physiologiquement immatures et plus vulnérables au stress oxydatif (Baeza et Coudert, 2023).
HumIPHORA montre une activité antimicrobienne prometteuse et des bénéfices potentiels chez les monogastriques. Ces résultats ouvrent des perspectives pour une validation supplémentaire par des essais contrôlés in vivo et des études expérimentales additionnels sur les performance productives.
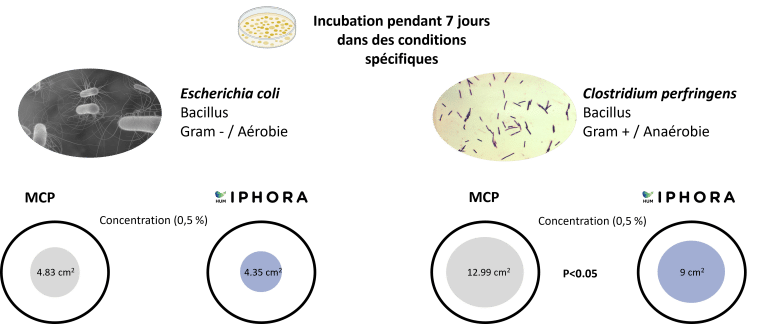
Figure 8 : Effet de HumIPHORA sur la croissance bactérienne (E. coli et C. perfringens)
